|
品牌:Sanplatec
CAS No.: 储存条件:室温 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
WEB28540 |
– | 1 EA | – | 咨询 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司。
产品描述相关资料下载相关产品浏览记录 请联系客服

|
品牌:Sanplatec
CAS No.: 储存条件:室温 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
WEB28540 |
– | 1 EA | – | 咨询 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司。
产品描述相关资料下载相关产品浏览记录 请联系客服
BioAct 体内成像工具
In Vivo Imaging Tools
活体光学成像是一种通过实时可视化小动物来监测生物信息的方法,可应用于药物开发、癌细胞检测和治疗反应监测等临床前研究阶段。荧光技术无放射性,半衰期长,便于多通道使用,而且其相关设备及仪器构造比放射性设备简单。由于以上这些特点,荧光技术应用于体内成像领域的研究近年已取得了积极的进展。
BioActs 提供的近红外(NIR)荧光染料波长范围为700~900 nm,无因生物物质自发荧光而引起的噪声,并且由于波长较长,可作为活体光学成像中的有效显像剂。
NpFlamma® HGC 系列
NpFlamma®HGC 是基于壳聚糖纳米粒开发的近红外 (NIR) 荧光造影剂。由于 NpFlamma® HGC 系列药剂的主要成分——壳聚糖是生物衍生材料,因此没有毒性问题,具有半衰期长、光稳定性好和可溶于水等优点。

图:使用 NpFlamma® HGC 染料进行有效肿瘤成像
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| BCT-PNC1201-T010 | NpFlamma HGC 648 | 10 tests | |
| BCT-PNC1201-T050 | NpFlamma HGC 648 | 50 tests | |
| BCT-PNC1201-T250 | NpFlamma HGC 648 | 250 tests | |
| BCT-PNC1401-T010 | NpFlamma HGC 675 | 10 tests | |
| BCT-PNC1401-T050 | NpFlamma HGC 675 | 50 tests | |
| BCT-PNC1401-T250 | NpFlamma HGC 675 | 250 tests | |
| BCT-PNC1301-T010 | NpFlamma HGC 749 | 10 tests | |
| BCT-PNC1301-T050 | NpFlamma HGC 749 | 50 tests | |
| BCT-PNC1301-T250 | NpFlamma HGC 749 | 250 tests | |
| BCT-PNC1601-T010 | NpFlamma HGC 774 | 10 tests | |
| BCT-PNC1601-T050 | NpFlamma HGC 774 | 50 tests | |
| BCT-PNC1601-T250 | NpFlamma HGC 774 | 250 tests | |
| BCT-PNC1501-T010 | NpFlamma HGC ICG | 10 tests | |
| BCT-PNC1501-T050 | NpFlamma HGC ICG | 50 tests | |
| BCT-PNC1501-T250 | NpFlamma HGC ICG | 250 tests |
实现生物体内部深处成像
AkaLumine-HCl(TokeOni)
AkaLumine-HCl 是一种发光峰值在 670-680 nm处的荧光素类似物。它适用于活体深部的体内成像,因为它的峰值范围在近红外(NIR)窗内,不易受水和血红蛋白吸收峰影响。
进行成像实验时敬请使用 AkaLumine-HCl。
数据提供:
东京工业大学 生命理工学院 生命理工学系 生命工程专业 口丸高弘助教·近藤科江教授
电力通信大学研究生院 信息科学与工程 基础科学与工程专业 牧昌次郎助教
参考文献:
1) Kuchimaru, T. , Iwano, S. , Kiyama, M. , Mitsumata, S. , Kadonosono, T. , & Niwa, H. , et al. (2016).
A luciferin analogue generating near-infrared bioluminescence achieves highly sensitive deep-tissue imaging.
Nature Communications, 7, 11856.
2) Iwano, S. , Sugiyama, M. , Hama, H. , Watakabe, A. , Hasegawa, N. , & Kuchimaru, T. , et al. (2018).
Single-cell bioluminescence imaging of deep tissue in freely moving animals.
Science, 359(6378), 935-939.
◆特点
● 近红外发光底物:λmax 675 nm。
● 不易受水和血红蛋白光吸收的影响,非常适合用于活体成像实验。
● 比传统产品 AkaLumine 的溶解度高 50 倍以上。
◆结构及光谱

图一. AkaLumine-HCL 结构式
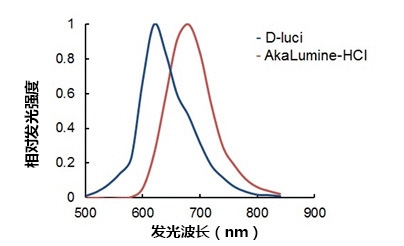
图二. D-luci(D-荧光素)及 AkaLumine-HCl 在含有 LLC/luc 皮下肿瘤的小鼠体内各基质中的发光光谱图
◆使用了小鼠的活体成像实验数据
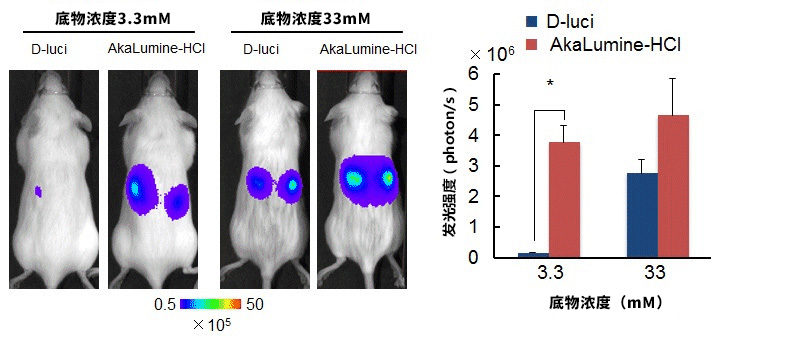
图三. 在含有 LLC/luc 皮下肿瘤的小鼠腹腔内使用 100 μL 底物 D-luci 及 AkaLumine-HCl,15 分钟后对所得的发光图像及肿瘤发光强度进行定
量分析(n=4,*P<0.05)。对小鼠使用 D-luci 并获得发光图像后4小时,对同一实验对象使用 AkaLumine HCl,得到如图所示的发光
图像。
◆细胞的体外成像实验数据
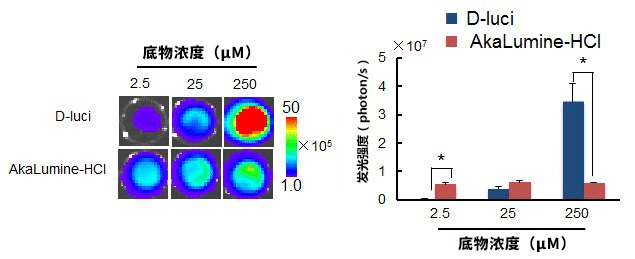
图四. 将各种底物浓度的 D-luci 及 AkaLumine-HCl 添加至表达萤火虫荧光素酶(luc,firefly luciferase)的小鼠鼠肺癌细胞(LLC/luc)内,
得到的发光图像及发光强度定量分析结果。(n=3,*P<0.05)
◆产品列表
|
产品编号 |
产品名称 |
规格 |
容量 |
|
012-26701 |
AkaLumine盐酸盐 |
生化学用 |
1 mg |
|
018-26703 |
10 mg |
◆相关产品
|
产品编号 |
产品名称 |
规格 |
容量 |
|
035-22991 |
腔肠荧光素h |
生化学用 |
1 mg |
|
031-22993 |
10 mg |
||
|
039-22994 |
50 mg |
||
|
035-22996 |
100 mg |
||
|
099-06571 |
异氟醚 |
生化学用 |
250 mL |
|
095-06573 |
1 L |
||
|
193-17791 |
七氟醚 |
生化学用 |
250 mL |
|
011-25791 |
马来酸乙烯丙嗪 |
药理研究用 |
10 mg |
|
017-25793 |
50 mg |
||
|
015-25331 |
阿替美唑盐酸盐 |
药理研究用 |
10 mg |
|
011-25333 |
50 mg |
||
|
049-33321 |
盐酸右美托咪定 |
药理研究用 |
1 mg |
|
045-33323 |
10 mg |
||
|
021-19001 |
酒石酸布托啡诺 |
生化学用 |
50 mg |
|
027-19003 |
500 mg |
||
|
135-13791 |
咪达唑仑 |
生化学用 |
500 mg |
|
139-17471 |
美托咪定盐酸盐 |
药理研究用 |
1 mg |
|
135-17473 |
10 mg |
||
|
133-17474 |
100 mg |
欲了解更多应用,请点击此处下载宣传单页
参考文献
|
1) |
Kuchimaru, T. , Iwano, S. , Kiyama, M. , Mitsumata, S. , Kadonosono, T. , & Niwa, H. , et al. (2016). A luciferin analogue generating near-infrared bioluminescence achieves highly sensitive deep-tissue imaging. Nature Communications, 7, 11856. |
|
2) |
Iwano, S. , Sugiyama, M. , Hama, H. , Watakabe, A. , Hasegawa, N. , & Kuchimaru, T. , et al. (2018). Single-cell bioluminescence imaging of deep tissue in freely moving animals. Science, 359(6378), 935-939. |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
无荧光性新型SHG成像用染料
Ap3, SHG成像染料
Ap3是一种无荧光性SHG染料,在SHG信号成像中不会发出障碍性荧光。它与常规的荧光性膜染色染料不同,可以只观察细胞膜的信号,因此能够用于分析细胞膜的准确位置。另外,由于SHG信号强度和膜电位相关,因此还能用于膜电位的成像。
※ 本产品仅供科研用,不可作其他用途。
※ 本产品基于庆应义塾大学 医学部药理学教室以及筑波大学 数理物质系(学际物质科学研究中心)的研究成果,由funakoshi进行商品化并销售。
※ Nuriya M., et al, Nat. Commun., 7:11557 (2016).
※ 庆应义塾大学医学部 药理学教室 塗谷老师的相关采访文章,请点击此处。
使用SHG专用染料对细胞膜现象进行成像
利用双光子现象之二次谐波产生(Second Harmonic Generation: SHG)
在显微镜下测量细胞膜形态和变化
庆应义塾大学 医学部药理学教室 塗谷睦生 老师
【背景】
细胞膜分隔细胞内外,可以作为在其周边产生的电信号和化学信息的传递场所,因此在细胞间和细胞内的信息传递中起着十分重要的作用。但是,由于其结构的精细和复杂性等,难以进行生理学上的分析。研究发现,对细胞膜具有高亲和力的染料在细胞膜中会发出强烈的SHG信号,由于该信号会根据膜电位而变化,因此研究认为,SHG成像在细胞膜的标记及其电位变化的分析等方面非常有效。
【无荧光性SHG专用染料Ap3】
Ap3是为了SHG成像而开发和合成的一种新型的无荧光性SHG专用染料,使用这种染料可实现观察其他荧光染料的同时观测。利用这一点,使用Ap3进行SHG成像可以观察到响应神经活动引起的膜电位变化,同时通过钙敏感性染料的荧光成像,还可以观察到膜附近钙浓度的变化。研究表明,使用Ap3进行的成像,由于光照射引起的信号衰减和细胞毒性非常低。因此利用Ap3能够可视化细胞膜,捕捉膜电位的变化,还可能同时对荧光蛋白的动态和报告荧光染料的信号变化进行长时间成像。因而使用Ap3对脑细胞、包括肌细胞在内的其他兴奋性细胞的生理学分析,或使用各种系统的离子通道的功能分析等的应用方面备受期待。
【展望】
除上述以外,SHG成像还可以对细胞膜的损伤和脂质成分,以及核酸或蛋白等生物分子的结构变化等多种生命现象进行高灵敏度检测。利用具有这种特殊能力的普通多光子显微镜系统,即可轻松地进行SHG成像,而且通过扩展专用染料的应用性,相信SHG成像作为生命科学领域研究中的新型工具会有更进一步的发展。
◆特点
● Ap3是SHG成像的专用染料。除 SHG信号外,不会发出荧光
● Ap3无荧光性, SHG成像的同时还能进行钙成像等荧光性成像的多模式成像
● Ap3是一种光稳定性高的化合物
● Ap3具有极低的光毒性,对细胞的损伤小
● 推荐光源:钛蓝宝石激光(波长标准:950 nm)
※ 在SHG成像中,需要双光子激发显微镜、SHG信号用滤光片(例如465-485 nm的带通滤光片)
※ 在SHG成像的观察中,物镜的另一侧(正置显微镜时为下方)需要检测系统。另外,在检测系统一侧建议使用具有光电倍增管(PMT)的显微镜。
◆操作方法要点
1. 在玻璃底培养皿中培养细胞;
2. 向细胞中添加终浓度为20 μM的Ap3溶液;
3. 使用双光子激发显微镜进行观察。
◆应用实例1
■ Ap3的SHG信号和无荧光性
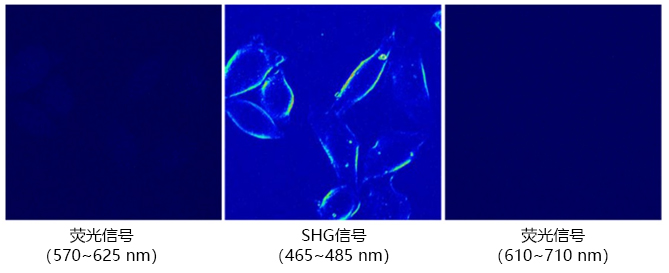
950 nm激光照射时,通过Ap3可观察到 SHG 信号,但未观察到荧光信号。
■ 脑切片中SHG成像的膜电位变化
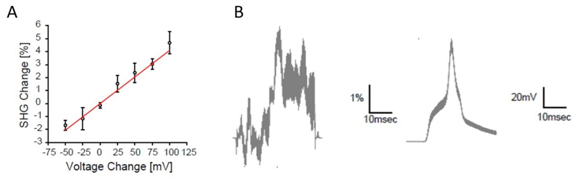
A:电压固定时SHG信号的膜电位敏感性
B:动作电位依赖性SHG信号变化(左)和通过膜片钳测量的电位变化(右)
Nuriya M., et al, Nat. Commun., 7:11557 (2016).
■ 同时测量脑切片中SHG成像的膜电位变化和荧光成像的钙浓度
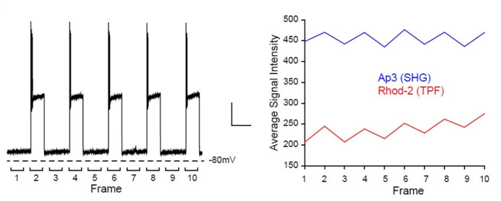
在脑切片中反复施加动作电位时(左;比例尺20 mV,5 s),观察Ap3的SHG信号和荧光性钙检测试剂Rhod-2的双光子荧光信号(TPF)(右)。在成像中同时测量的膜电位变化和钙浓度变化。
Nuriya M., et al, Nat. Commun., 7:11557 (2016).
◆应用实例2
■ 比较多模式双光子显微镜下的细胞膜选择性SHG成像和细胞膜荧光成像

用Ap3对表达细胞膜观察用膜锚定GFP的细胞进行染色,同时可视化在950 nm飞秒激光照射下GFP的双光子荧光(TPF,绿色)和Ap3的SHG(洋红色)信号。
由于GFP信号不仅从细胞膜,还会从囊泡等许多细胞内的膜结构中发出强烈的荧光,因此难以准确地识别出细胞膜的位置。与之相对的,Ap3的 SHG 信号只能从细胞膜发出,从而可以实现细胞膜的选择性成像和位点的准确识别。
Mizuguchi T., et al, iScience., Nov 30 ; 9 :359~366 (2018).
■ 分析多模式双光子显微镜下细胞膜正下方的囊泡动态和肌动蛋白
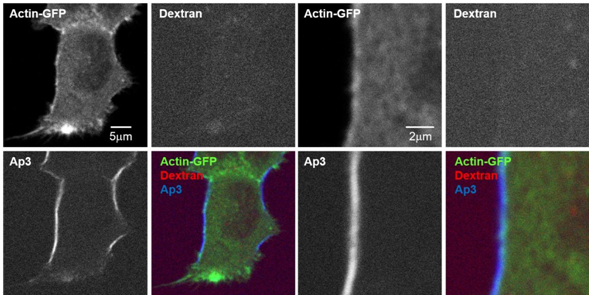
在表达GFP标记肌动蛋白的细胞中,分别用红色荧光标记Dextran染色胞吞后的囊泡,用Ap3染色细胞膜,同时利用多模式双光子显微镜进行可视化。
Ap3的SHG信号具有细胞膜特异性,而且可以与荧光信号完全分离,因此能够通过Ap3的SHG信号准确识别细胞膜的位置,从而准确地测量从细胞膜到肌动蛋白骨架的距离。
Mizuguchi T., et al, iScience., Nov 30 ; 9 :359~366 (2018).
■ 分析多模式双光子显微镜下质膜正下方的囊泡动态和微管蛋白
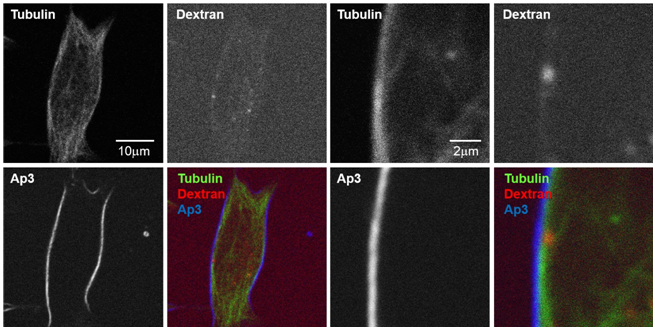
在经过微管蛋白可视化试剂染色的细胞中,分别用红色荧光标记Dextran标记胞吞后的囊泡,用Ap3标记细胞膜,利用多模式双光子显微镜进行可视化。
Ap3的SHG信号具有细胞膜特异性,而且可以与荧光信号完全分离,因此能够通过Ap3的SHG信号准确识别细胞膜的位置,而且可以测量从细胞膜到微管,以及细胞膜正下方囊泡移动的准确距离。
Mizuguchi T., et al, iScience., Nov 30 ; 9 :359~366 (2018).
※ 本页面产品仅供研究用,研究以外不可使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| FDV-0008 | Ap3, SHG Imaging Dye Ap3, SHG成像染料 |
1 mg | – |
高灵敏度脂滴长时间成像荧光染料
LipiDye® Ⅱ
LipiDye® II 是一款可用于长时间活细胞成像的高灵敏度优质脂滴染料试剂。此外,它还具有脂滴特异性高、毒性低和光稳定性高的优点。适用于以天数为单位的长时间观察、脂滴融合和分解过程的活细胞成像以及使用超高分辨率显微镜的超微小脂滴可视化。
LipiDye® II 是LipiDye®(#FDV-0010)的改良版试剂,关于LipiDye® 的产品信息,请点击此处查看。
※ 本产品基于名古屋大学 变革生命分子研究所 山口茂弘教授、多喜正泰特任准教授的研究结果,由funakoshi株式会社进行商品化并销售。
※ 本产品仅供研究用,请勿用于研究以外用途。
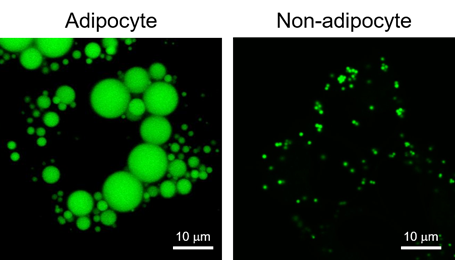
使用LipiDye® II染色脂肪细胞和非脂肪细胞的案例
◆关于脂滴(Lipid droplet)和LipiDye®
脂滴(Lipid droplet)是在脂肪细胞(Adipocyte)中发现的大型中性脂肪的结块,主要成分是甘油三酯(Triglyceride)和甾醇酯(Sterol Ester)的单分子层结构体(图1)。脂滴被认为是储存细胞内中性脂质的细胞器,并且有较多肥胖和疾病相关的报道。最近,除了脂肪细胞,还在肝细胞、平滑肌细胞、神经胶质细胞等各种细胞中发现了脂滴。这些发现明确了其不仅仅是作为中性脂质的储存场所,还有抑制代谢和调节基因表达等各种功能。对各种细胞中的脂滴进行观察发现,非脂肪细胞的脂滴在1 μm以下,与脂肪细胞中的10~100 μm的脂滴相比较小(图2)。因此,可以利用成像来检测活细胞中非脂肪细胞的微小脂滴的试剂备受期待,但目前Nile Red等现有试剂会观察到脂滴以外的染色试剂(信噪比低),不适用于活细胞成像,观察微小脂滴仅限于电子显微镜观察。
而LipiDye® 是一款可以显示高S/N比率的脂滴染色试剂,虽然检测1 μm以下的小脂滴的效果优异,但从光稳定性的观点来看,长时间活细胞成像的效果不佳。而LipiDye® II 是名古屋大学 变革生命分子研究所(ITbM)的山口教授、多喜特任准教授为了解决上述问题而研发的新型脂滴检测试剂(参考文献中的名称为LAQ1),光稳定性非常高,毒性低,适合用于长时间稳定的活细胞成像。
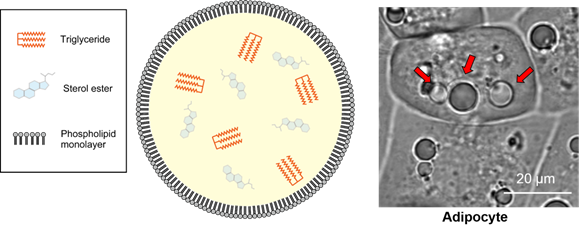
图1:脂滴的模式图及脂肪细胞(adipocyte)中可见的大型脂滴
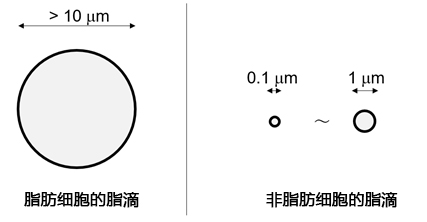
图2:不同细胞类型中脂滴的成像图例
◆特点
● 不仅可以选择性浓缩脂滴,还会响应疏水性环境而发出荧光,因此可以抑制细胞质等的部分发光,对脂滴有着高信噪比(S/N比)
● 可检测非脂肪细胞中的小型脂滴(小于1 μm)
● 光稳定性高,长时间活细胞成像效果优异
● 由于不会褪色,可用于脂滴分解过程中的荧光观察
● 在推荐的使用浓度(0.1~1 μM)中几乎不显示细胞毒性。在已添加试剂的状态下,脂肪细胞分化过程的观察记录最长达8天
● 活细胞、固定细胞都可使用。也适用于活细胞染色后再固定处理的情况
● 也适用于STED超高分辨率显微镜。可观察到约200 nm(半峰全宽)的脂滴
◆关于荧光波长(激发/发射波长)
激发/发射波长:400~500 nm/490~600 nm
※ 虽然最大吸收为410~420 nm,但也可用450~500 nm范围的光源激发。详情请参考下方的激发/发射光谱数据。
※ 可用800 nm激光进行双光子激发。详情请参考下方利用双光子显微镜观察小胶质细胞。
※ 可进行多重染色,但需要注意波长的选择。请使用激发光在500 nm以上的染料。若使用在450 nm以下的范围内激发的普通蓝色荧光染料,可能
※ 会同时激发本试剂。
■ 光源示例
|
激发光 |
405 nm、 445 nm、 458 nm、 473 nm、 488 nm*等 |
|
光源+滤光片 |
可利用一般的FITC或GFP滤片。 |
|
STED超高分辨率显微镜 |
推荐激发光:473 nm激光,STED光:660 nm激光 |
◆LipiDye® 与其他试剂相比的优点
|
试剂名称 |
颜色 |
激发光的波长 |
活细胞的染色 |
固定细胞的染色 |
光稳定性 |
延时成像 |
多重染色 |
S/N比率 |
|
LipiDye® II |
绿色荧光 |
400~500 nm |
可 |
可 |
非常高 |
超长时间 可 |
可(注意波长的选择) |
高 |
|
LipiDye® |
绿色荧光 |
400~470 nm |
可 |
可 |
高 |
短时间 可 |
可(注意波长的选择) |
高 |
|
Nile Red |
红色荧光 |
~510 nm |
可 |
可 |
低 |
不适合 |
不适合 |
低 |
|
荧光染料B |
绿色荧光 |
~480 nm |
可 |
可 |
低 |
可 |
可 |
中 |
|
脂滴染色试剂A |
红色和绿色荧光 |
—— |
不可 |
可 |
未知 |
不可 |
可 |
高 |
|
Oil Red O |
红色染料 |
—— |
不可 |
可 |
—— |
不可 |
—— |
低 |
◆参考文献
"Fused Thiophene-S,S-dioxide-Based Super-Photostable Fluorescent Marker for Lipid Droplets."
Taki, M., et al., ACS Mater. Lett., 3(1), 42~49 (2021)
◆参考数据
激发/发射光谱
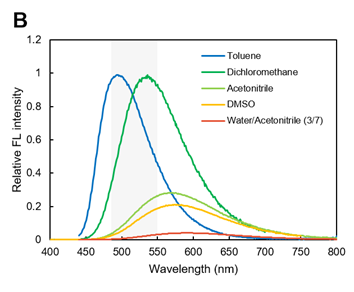
LipiDye® II是溶剂环境响应型荧光染料(Solvatochromic dye),会根据周围的分子极性改变荧光波长。吸收光谱几乎不受溶剂的影响,可观察到在380~500 nm的吸收(图A)。
● 推荐激发光:405 nm、445 nm、458 nm、473 nm激光
● 可使用的激发光:488 nm激光(由于荧光强度弱,建议根据不同的实验对使用浓度等进行验证。)
另外,荧光光谱依赖于溶剂极性,在甲苯和二氯甲烷等疏水性环境下会显示强烈的蓝~绿色荧光,但在乙腈、DMSO和水溶液等高极性环境下,极性越大,最大荧光就会转移至长波长一侧,对荧光强度的抑制就越明显(图B)。根据这个特性,可观察到脂滴在疏水性环境下的特异性绿色荧光。
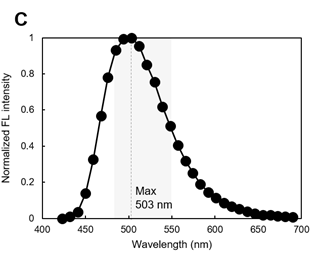
用LipiDye® II对细胞染色,用显微镜光谱扫描脂滴部分,评估脂滴的荧光,约在500 nm附近可观察到最大的荧光光谱(图C)。
※ 图A~图C的灰色阴影区域为推荐激发/荧光波长。

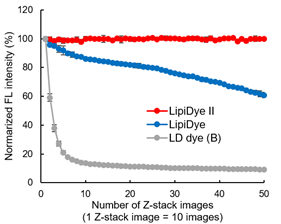
光稳定性
用4%多聚甲醛固定处理3T3-L1脂肪细胞,再分别用新产品LipiDye® II、旧款产品LipiDye® 和传统的荧光染料B染色,之后使用共聚焦激光显微镜反复进行Z-stack成像(激发473 nm/荧光:490~540 nm),观察荧光强度的变化。在Z-stack成像中,每拍摄一次可获取10张2 μm的图像。传统染料B经过约5次的Z-stack成像后衰减明显,而相比之下,旧款产品LipiDye®虽然有耐光性,但也观察到了缓慢的衰减,在经过50次的Z-stack成像后荧光衰减至60%左右。
而在本试剂LipiDye® II中,即使经过50次(共计500次的光照射),其荧光强度也几乎不发生变化。显示了LipiDye® II具有非常高的光稳定性,适用于长时间的延时成像(包括Z-stack成像)。
细胞毒性
使用不同浓度的LipiDye® II 处理 3T3-L1脂肪细胞,然后使用MTT Assay评估24 h后的细胞活性。本试剂的推荐使用浓度为0.1~1 μM,但至少在5 μM内未观察到细胞毒性。在10 μM以上才观察到细胞毒性。

活细胞和固定细胞染色
用LipiDye® II对活细胞状态下的3T3-L1脂肪细胞染色,然后在活细胞中进行荧光观察(左图)。之后,用4%多聚甲醛固定细胞,清洗后在固定状态下再次进行荧光观察(右图)。固定前后几乎未观察到荧光信号的变化。表明了本试剂除了可用于活细胞染色,也可兼容固定细胞的免疫染色。
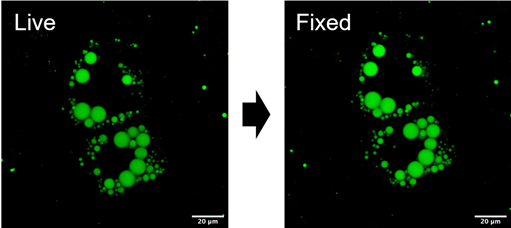
LipiDye®染色的活细胞和经PFA固定后的荧光强度的对比
◆应用数据
在各种细胞中的染色
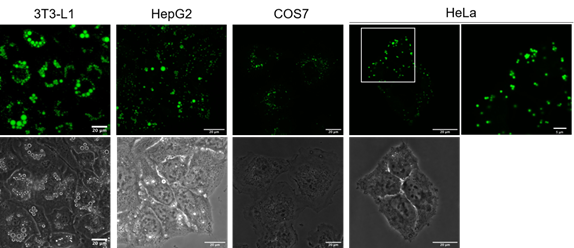
用LipiDye® II(1 μm)分别染色3T3-L1、HepG2、COS-7、HeLa细胞,在共聚焦激光显微镜下观察绿色荧光(激发473 nm/荧光490~540 nm)(比例尺:20 μm)。在HepG2中,为使脂滴形成,用脂肪酸处理了1天。在HeLa细胞中可清晰地观察到1 μm以下的小脂滴(参考Hela细胞放大图像(右侧),比例尺:5 μm)。
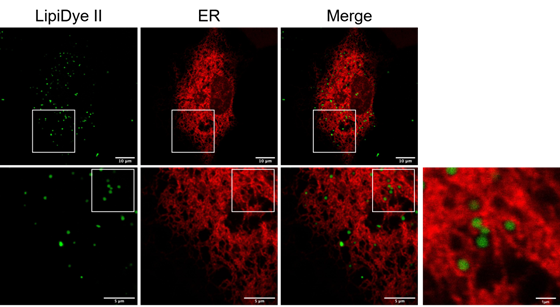
内质网(ER)标记及其多色成像
用LipiDye® II(1 μm)对表达内质网(ER)驻留红色荧光蛋白(ER-mKO1)的COS-7细胞进行染色,使用共聚焦激光显微镜进行荧光观察(LipiDye® II:激发473 nm/荧光490~540 nm,ER-mKO1:激发559 nm/荧光570~620 nm)。可以观察到COS-7细胞内部的小脂滴(<1 μm),并且大部分驻留于内质网结构的内侧(参考右侧的放大图,比例尺:1 μm)。该结果表明内质网中存在脂滴的生物合成。
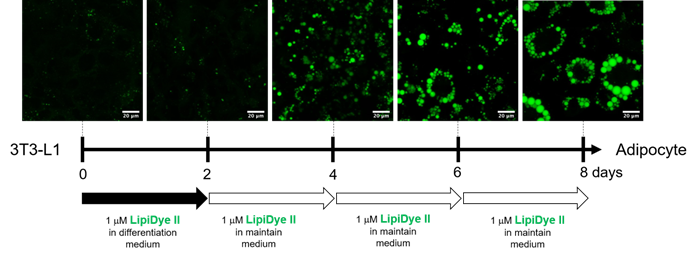
长时间观察脂肪细胞的分化过程
用LipiDye® II在共聚焦激光显微镜下观察活细胞中诱导前脂肪细胞3T3-L1分化为脂肪细胞时,成熟脂滴的状态8天(激发473 nm/荧光490~540 nm)。前2天在含LipiDye® II的分化培养基中培养3T3-L1细胞,之后每隔两天更换至含LipiDye® II(1 μm)的维持培养基中,荧光观察共计8天。即使用LipiDye® II进行长时间的处理,也没有细胞毒性和对脂肪细胞分化产生影响,可以观察到脂滴成熟的过程。
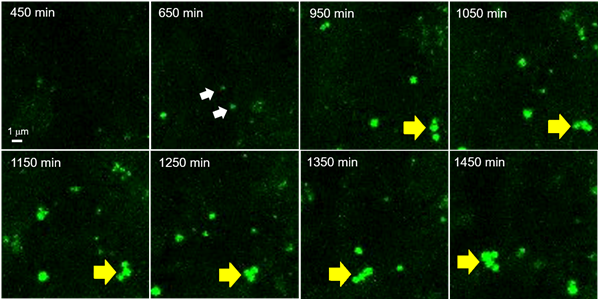
活细胞成像中新生脂滴的动态行为分析
利用长时间延时成像(Z-stack成像),观察在诱导前脂肪细胞3T3-L1分化为脂肪细胞时新生脂滴的动态行为约24 h(共聚焦激光显微镜:激发473 nm/荧光490~540 nm,每10 min拍摄一次,Z-stack 20张/次)。向预先已经用LipiDye® II染色的前脂肪细胞中添加分化培养基(含有LipiDye® II),然后立即开始延时成像。分化诱导后约10 h,开始看到小脂滴的出现(650 min,白色箭头),可以观察到各脂滴在相互作用的同时,不断成长的状态(950~1450 min,黄色箭头)。
观察脂滴分解·新生过程随着时间的变化
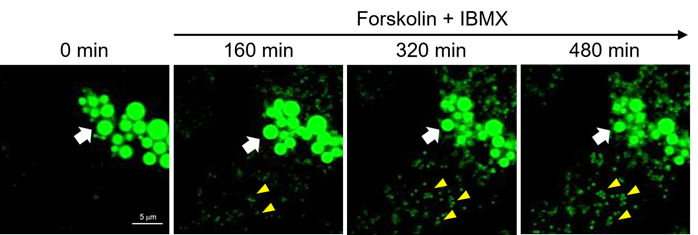
向分化诱导的3T3-L1细胞中添加腺苷酸环化酶激活剂Forskolin(10 μM)和磷酸二酯酶抑制剂IBMX(100 nM),观察在使用了LipiDye® II的延时成像(Z-stack)中脂滴随着三酰基甘油的分解而缩小的过程(共聚焦激光显微镜:激发473 nm/荧光490~540 nm,800 min,每4 min拍摄一次,Z-stack 15张/次)。从图中可以看到原本的大脂滴(请参见白色箭头)随着时间的推移逐渐变小。另外,可以看到随着时间的推移又产生了许多小脂滴(黄色三角形)。
结果表明,LipiDye® II具有非常高的光稳定性,无需担心褪色;并有着高信噪比,可以观察到微小的新生脂滴,因此可以定量观察脂滴的增减。
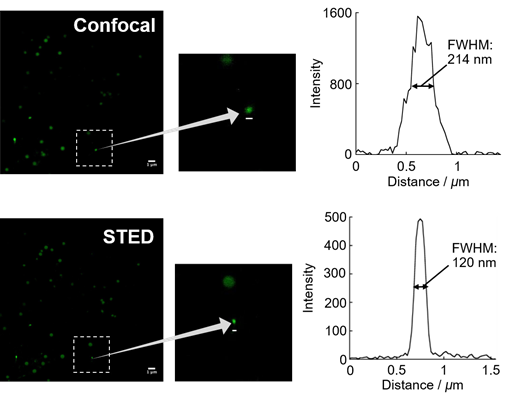
利用STED超高分辨率显微镜可视化微小脂滴
用LipiDye® II(1 μm)染色Hela细胞,使用激光共聚焦显微镜(Confocal)(激发473 nm/荧光490~540 nm)和STED超高分辨率显微镜(激发473 nm + STED 660 nm/荧光500~640 nm)对微小脂滴进行观察。STED观察图像显示的是经过反卷积处理的数据。从图中可以发现在共聚焦激光显微镜下较为模糊的微小脂滴,在STED显微镜中非常清晰,半峰全宽(FWHM)约为120 nm。
※ 关于STED显微镜的观察条件及分析方法,请见参考文献。
利用双光子显微镜观察小胶质细胞
向大鼠原代培养小胶质细胞中添加LipiDye® II(1 μm),染色过夜后,用4%PFA固定,然后在双光子显微镜下进行观察。可见LipiDye® II使用双光子激发法也可以激发,可以检测原代培养小胶质细胞中尺寸各异的脂滴。
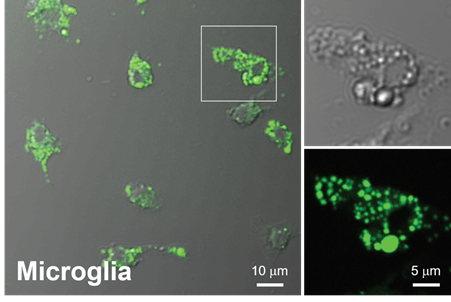
(数据提供:Dr. Hyun Beom Choi以及 Dr. Brian MacVicar, The University of British Columbia)
第一代产品点击此处查看
※ 本页面产品仅供研究用,研究以外不可使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| FDV-0027 | LipiDye® II ( Live Imaging) LipiDye® II(脂滴活细胞成像试剂) |
0.1 mg | – |
Pearl® Trilogy 近红外荧光&生物发光小动物活体成像系统
Pearl Trilogy是LI-COR公司推出的一款专业的近红外荧光和生物发光成像系统,专为小动物活体成像量身定做。该系统保持了近红外荧光在活体成像中背景低,穿透力好的特点,同时具备生物发光检测的能力,满足客户多样的需求。此外,仪器操作简便,您无需成为仪器的操作专家,就可以获得高质量的实验结果。
1.均匀照明;
2.穿透力强;
3.灵敏度高;
4.背景低;
5.动态范围宽;
6. 具有丰富的肿瘤相关检测/示踪探针
检 测 器: CCD,半导体制冷; 采集速度: 500 ms – 60 s; 通 道:白光通道、生物发光通道、双色近红外荧光成像通道;
荧光染料: IRDye® 680RD、IRDye 700DX、IRDye 800RS、IRDye 800CW、Alexa Fluor 680、Alexa Fluor 790和Cy® 5.5; 分 辨 率: 85,170或255 μm; 图像显示: 伪彩、灰度、单色(红色、绿色或蓝色),或者双色; 通 量: 1只; 成 像 床: 16.8 cm W×12 cm D,成像床到抽屉顶部的垂直距离3.8 c;m 成像面积: 11.2 cm W×8.4 cm D; 成像床温控范围: 32-42℃; 气体麻醉: 可配合麻醉系统使用; 仪器尺寸: 41 W ×41 D×66 cm H; 仪器重量: 23 kg
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 9430-00 | Pearl® Trilogy 近红外荧光&生物发光小动物活体成像系统 | 黑色 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
Odyssey® XF 双色红外激光成像系统
Odyssey® XF 成像系统兼具近红外荧光成像和化学发光成像功能。近红外荧光成像功能是定量western Blot检测的金标准也是蛋白质研究的多功能平台;具有重复性高、定量准确、 双色荧光成像、背景低、灵敏度高、可直接检测、应用范围广等特点;的FieldBriteTM XT2技术使Odyssey Fc具有均一的照明从而获得清晰的图像。超过6个数量级的动态范围使您无需担心条带过曝,定量结果更加准确。
1.重复性高:稳定的近红外荧光信号与目标蛋白表达丰度成比例并具有更好的线性,保证了高重复性;
2.定量准确:更宽的线性动态范围,同时采集强信号和弱信号,实现了真正的定量Western Blot;
3.灵敏度高 背景低:高能量、波长特异性的近红外激光器以及近红外荧光背景低的特点,能够获得高灵敏度和优异的图像质量;
4.双色成像: 双色荧光Western Blot允许同时检测两个及以上目标蛋白,相比Stripping和Reprobing的操作方法更加准确,重复也更高,更适合内参蛋白和目的蛋白同时检测,蛋白修饰研究中的磷酸化、乙酰化、糖基化等研究;
5.应用范围广:可实现近红外荧光Western Blot 、化学发光Western Blot、核酸胶成像、ECL蛋白质芯片、拷染胶成像等:
6.软件功能强大:Empiria Studio软件是由LI-COR与Nature等顶级期刊杂志合作开发的一款超级强大的 Western Blot数据统计学分析软件,在几分钟之内自动完成统计学分析,自动进行均一化、自动给出平均值/标准方差等信息,自动给出统计学散点图或带Error Bar的柱状图。
成像面积: 12 cm×10 cm; 动态范围: 22 bit(>6 logs); 的FieldBriteTM XT2技术: 照明均一性CV<3%; 700通道激光光源: 685 nm固态激光器; 800通道激光光源: 785nm固态激光器; 600通道光源: 520nm漫射光源; 近红外荧光成像时间: 30s-10min连续可调 化学发光成像时间: 30s-60min连续可调 使用环境 15-35℃,露点温度<22℃,非压缩 聚焦: 自动聚焦;
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 2802-00 | Odyssey® XF 双色红外激光成像系统 | 黑色 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
Odyssey® M 多模式成像分析系统
产品概述
Odyssey® M 多模式成像分析系统是LI-COR公司新研发的成像分析系统,提供近红外荧光、可见荧光、发光等多种成像模式;具有更高的分辨率、更高的灵敏度,更准确的定量检测,提供更先进的创新方案。
1. 可检测的实验类型更广泛: 包括并不限于组织切片成像,膜成像,In / On-Cell Western 、ELISA 、细胞活力状态等基于孔板的实验,DNA胶、蛋白胶、EMSA等基于胶的成像等等。这种广泛的应用范围帮助您不断地扩展研究方向,节省额外购买或更换仪器的时间和经费;
2. 检测通道: 多达18个;
3. 动态范围: 超过6logs的宽动态范围,避免信号饱和,获得准确的定量数据;
4. 高分辨率: 高达5μm分辨率进行精细成像;
5. 发光模块可选;
6.重复性高:稳定的近红外荧光信号与目的蛋白表达丰度成比例并具有更好的线性,保证了高重复性;
7.定量准确:更宽的线性动态范围,同时采集强信号和弱信号,实现了真正的定量Western Blot;
8.多色成像:多达18个通道,兼容可见荧光、近红外荧光、化学发光等多种模式,真正实现了多色成像;
9.软件功能强大:Empiria Studio 软件是由LI-COR于Nature等期刊杂志合作开发的原超级强大的Western Blot 数据统计学分析软件,在几分钟之内完成统计学分析,自动机芯均一化,自动给出平均值/标准方差等信息,自动给出散点图或带Error Bar的柱状图。
技术指标
总成像面积:25 cm×18 cm;
分辨率:≤5μm
动态范围:≥6 logs;
检测器:
荧光检测:sCMOS
化学发光检测:CCD(像素尺寸:6.45μm)
激光器寿命:≥20000个工作小时;
软件
LI-COR Acquisition 软件
Empiria Studio® Software
光源:
785 nm固态激光器
685 nm固态激光器
520 nm固态激光器
488 nm固态激光器
RGB LED光源(落射光源)
RGB LED光源(透射光源)
焦距:-1 mm- 5mm范围内可调
尺寸: 61 cm W × 76 cm D × 38 cm H
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 3350-00 | Odyssey® M 多模式成像分析系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
Odyssey® DLx 双色红外激光成像系统
Odyssey® DLX 双色红外激光成像系统采用的近红外荧光成像技术,是定量western Blot检测的金标准也是蛋白质研究的多功能平台。具有重复性高、定量准确、 双色荧光成像、背景低、灵敏度高、可直接检测、应用范围广等特点。
1.重复性高:稳定的近红外荧光信号与目标蛋白表达丰度成比例并具有更好的线性,保证了高重复性;
2.定量准确:更宽的线性动态范围,同时采集强信号和弱信号,实现了真正的定量Western Blot;
3.灵敏度高 背景低: 高能量、波长特异性的近红外激光器以及近红外荧光背景低的特点,能够获得高灵敏度和优异的图像质量;
4.双色成像:双色荧光Western Blot允许同时检测两个及以上目标蛋白,相比Stripping和Reprobing的操作方法更加准确,重复也更高,更适合内参蛋白和目的蛋白同时检测,蛋白修饰研究中的磷酸化、乙酰化、糖基化等研究;
5.应用范围广:可实现近红外荧光Western Blot 、In-Cell Western Blot检测 、On-Cell Western Blot检测 、 组织切片成像、EMSA/凝胶迁移实验、核酸胶成像、荧光蛋白质芯片、荧光核酸芯片、拷染胶成像、器官成像等;
6.软件功能强大:Empiria Studio软件是由LI-COR与Nature等顶级期刊杂志合作开发的一款超级强大的 Western Blot数据统计学分析软件,在几分钟之内自动完成统计学分析,自动进行均一化、自动给出平均值/标准方差等信息,自动给出统计学散点图或带Error Bar的柱状图。
成像面积: 25 cm×25 cm; 动态范围: >6 logs; 扫描速度: 5-40 cm/s; 700通道激光光源: 685 nm固态激光器; 800通道激光光源: 785 nm固态激光器; 分辨率: 21 – 337 μm; 使用环境: 15-35℃,露点温度< 20℃; 焦距: 0 mm- 4mm范围内可调, 可以扫描膜、凝胶、微孔 板、组织切片等;
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 9142-00 | Odyssey® DLx 双色红外激光成像系统 | 黑色 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
BG-gdsAUTO710Pro化学发光成像系统
BG-gdsAUTO710Pro
一体式化学发光成像分析系统。极大节约实验室空间,免安装,避免设备兼容问题。
化学发光成像系统BG-gdsAUTO710Pro应用范围:
1.化学发光检测:Western Lightning、ECL、ECLplus、CDP Star、SuperSignal、CSPD、LμmiGlo等发光底物。
2.功能特点:
科研级深度制冷CCD搭配F0.8大光圈镜头,提高检测灵敏度,保证成像质量;
12.1寸触摸电容屏,满足人体工学设计,角度可调;
代替暗室曝光。
一键曝光功能和预估曝光时间功能;
软件终身免费升级
1.品名:化学发光成像系统BG-gdsAUTO710Pro。
2.CCD感光芯片 : CCD制冷芯片 。
3.摄像头:高分辨率低照度数码制冷相机 。
4.冷却方式 :半导体制冷 。
5.冷却温度:低于环境温度 75 ℃(绝对温度 -45 ℃,动态实时显示CCD制冷温度) 。
6.检测信噪比:≥ 56 dB 。
7.分辨率:2750×2200,605万像素 。
8.采集位数:16 bit 。
9.镜 头:F/0.8,高清晰大口径高通透微距定焦镜头,无需调整 。
10.动态范围:﹥4.5个数量级
11.感光效率:>75%
12.带有对应成像和分析软件。
13.安装:免费安装调试培训 。
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 206-150-001 | BG-gdsAUTO710Pro化学发光成像系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
BG-gdsAUTO520凝胶成像分析系统
BG-gdsAUTO520
1.用于蛋白质泳道分析、DNA/RNA分子量计算、单一条带分析、 Dot-blot电泳分析、菌落计数-培养皿计数、测量面积/密度、 印迹杂交膜放射自显影胶牌、 酶标板、薄层层析板。
2.能够自动识别和手动识别泳道/条带,并对泳道/条带编号,调整泳道(增加/删除),具有泳道矫正功能。
3.全自动控制功能:通过软件实现对图像处理及采集功能直接操作。
4.图像处理功能:调整图像大小、调整亮度、调整灰度、调整对比度、图像旋转、图像反色、图象裁切、图象缩放。
5.具有双向电泳结果分析功能。
6.数据结果与 MS Excel无缝联接。
7.软件终身免费升级
1.数码高分辨率低照度积分摄像头。
2.有效像素:2592×1944(503万)。
3.预览显示:12寸 工业显示屏。
4.检测灵敏度:可测出低至 0.02 ng 的核酸。
5.像素点大小:5.2 × 5.2 μm 。
6.触摸屏、键盘或鼠标均可进行变焦、聚焦、光圈、透射紫外灯及反射灯的全自动控制。
7.电脑控制:高度程序化(电脑控制暗箱/电源/紫外及白光灯的开关/光圈/焦距)。
8.割胶装置:专用观察和割胶装置(可视角度与物体为90度)。
9.镜头:采用日本Computer高通透自动变焦镜头8-48mm,根据要求随意缩放凝胶尺寸。
10.滤色镜片:专为多种荧光染料凝胶成像特性研制的镀膜滤镜UV/IR590nm。
11.定时关机:15分钟定时关机功能,有效延长紫外灯管和紫外玻璃的使用寿命。
12.开门: 下拉式开门和抽屉式载样台。
13.白光透射:21 × 26 cm; 白光板自带电源,光照更均匀使用寿命可长达10万个小时。
14.透射波长:312 nm (254 nm、365 nm为选配件)。
15.载样板尺寸:紫外透射20 × 25 cm、白光透射 20 × 25 cm。
16.包含凝胶图像分析软件
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 206-170-001 | BG-gdsAUTO520凝胶成像分析系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
PathFusion 手动成像分析系统-CPQBNS03-M
PathFusion Manual System
PathFusion 手动成像分析系统适用于荧光切片、HE、IHC切片的手动成像以及荧光核型切片、Fish切片、IHC染核或染膜的切片分析。包含GenASIs的软件包和5MP CMOS彩色相机。该系统可支持市面上大部分型号的显微镜,如olympus BX43BX53 和zeiss A1A2等。
系统参数:
1. Case Data Manager™软件用于数据的获取、查看和管理。
2. GenLink™软件用于网络连接和同一网络中多个系统连接。
3. SpotScan™ 软件用于FISH切片的成像,图片查看和分析。TissueFISH™ 软件用于组织FISH查看和分析
4. 五百万CMOS单色相机5MP CMOS
5. 2/3" 高分辨率单色数码CMOS
6. 分辨率2448X2048像素
7. 像素尺寸: 3.45 µm x 3.45 µm
8. 成像速度更高达35帧每秒
9. 像素深度:12比特
10. 连接方式:USB3接口
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| CPQBNS03-M | PathFusion 手动成像分析系统-CPQBNS03-M | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
HiFish 手动成像分析系统
HiFish Manual System
HiFish 手动成像分析系统适用于荧光切片的手动成像和分析系统。包含GenASIs的软件包和5MP CMOS单色相机。该系统可支持市面上大部分型号的显微镜,如olympus BX43BX53 和zeiss A1A2等。
系统参数:
1. Case Data Manager™软件用于数据的获取、查看和管理。
2. GenLink™软件用于网络连接和同一网络中多个系统连接。
3. FISHView™ 软件用于荧光核型分析,图片的处理和存档。
4. 五百万CMOS单色相机5MP CMOS
5. 2/3" 高分辨率单色数码CMOS
6. 分辨率2448X2048像素
7. 像素尺寸: 3.45 µm x 3.45 µm
8. 成像速度更高达35帧每秒
9. 像素深度:12比特
10. 连接方式:USB3接口
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| CPQBNS05-M | HiFish 手动成像分析系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
CELENA® S数字成像系统
CELENA® S Digital Imaging System
一台仪器实现图像采集和数据分析,替代设置复杂的传统荧光显微镜、广义成像设备、计算机和图像分析软件。小巧、强大、容易使用,CELENA®S数字成像系统使得采集可供发表的高质量荧光、明场以及相差图像变得轻而易举。用户友好界面的软件兼容了诸多图像应用例如图像采集,分析、活细胞成像、Z轴层叠成像以及自动细胞计数功能。
| CELENA®S数字成像系统技术参数 | |
| 成像模式 | 反射荧光和透射白光(明场和相差) |
| 光源 | 强度可调的LED滤镜立方体(每个立方体寿命超过50000小时) |
| 荧光通道 | 3色荧光通道和1个透射光通道 |
| 物镜盘 | 5个位置 |
| 物镜 | 高质量长工作距离(LWD)物镜和盖玻片校正物镜;1.25X-100X |
| 聚光器 | 3个位置LWD聚光器,带有明场和相差环 |
| 计算机 | 软件内嵌式双核CPU,128GB固态硬盘 |
| 载物台 | X/Y轴机械移动,Z轴电动移动载物台,兼容载物台孵育系统。 |
| 相机 | 130万单色科研级CMOS,1920×1024像素 |
| 图像格式 | 8bit或16bit的TIFF,JPG,BMP,PNG格式可选 |
| 尺寸大小(LxWxH) | 44x30x675px(17.3”x11.6”x10.6”) |
| 重量 | 20Kg |
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| CS20001 | CELENA® S数字成像系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
BG-gdsAUTO720化学发光凝胶成像系统
BG-gdsAUTO720
性能特点 。
1.可通过 F/0.8, 高清晰大口径高通透定焦镜头与高灵敏度数码制冷CCD的完美结合,使实验者摆脱烦琐的传统的暗室胶片曝光方式,方便快速高效地获得化学发光的实验结果。 。
2.化学发光与普通凝胶检测的一体化设计,提高实验的效率; 。
3.可通过电脑进行聚焦、透射光源及反射光源的全自动控制; 。
4.可通过电脑进行凝胶与化学发光图像的实时观测 。
5.可通过一键拍摄无需揣摩曝光时间,一键完成western blot结果成像 。
6.可通过一次拍摄无需任何操作即可将marker图像与化学发光图像自动叠加并且自动生成三种不同效果的化学发光图像 。
7.可设定连续采样的次数、起始及终止曝光时间,进行动态连续拍摄而方便获得更佳条件和效果的实验结果; 。
8.应用范围 :
8.1 印迹膜Chemilμminescent、 ECL、ECL plus、CDP Star、SuperSignal、CSPD、 LμmiGlo等。
8.2 核酸检测各种荧光染料,如Ethidiμm bromide、SYBR Gold、SYBR Green、GelSafe、GelRed、GelGreen、SYBR Safe、GelStar
8.3 蛋白检测考马斯亮蓝胶,银染胶,以及各种染料Coomassie Blue、Copper stain、Zinc stain、Flamingo、Oriole、Silver stain、Coomassie Fluor Orange、SYPRO Ruby、Krypton标记胶/膜/芯片等; 。
8.4 其他应用各种杂交膜、蛋白转印膜、培养皿菌落计数、酶标板、点杂交、蛋白芯片、TLC板
1.致冷CCD:美国原装品牌高分辨率低照度数码制冷CCD芯片Sony ICX285。
2.冷却方: 半导体制冷。
3.冷却温度:低于环境温度 75 ℃(绝对温度 -55 ℃,动态可调实时显示CCD制冷温度)。
4.有效像素: 2750× 2200 (605万像素) 。
5.像素合并: 1×1,2×2,3×3,4×4 。
6.镜头:F/0.8, 高清晰大口径高通透定焦镜头,可通过计算机对焦距电动调整。
7.数据位数:16 bit(65536灰阶)。
8.动态范围 ﹥4.5个数量级 。
9.拍摄:一次拍摄无需任何操作即可将marker图像与化学发光图像自动叠加并且自动生成三种不同效果的化学发光图像 。
10.一键拍摄:无需揣摩曝光时间一键完成western blot结果成像 。
11.紫外:透射紫外,反射紫外
12.辅助光源透射:LED白光板; 双侧反射:反射白光灯(冷光)可通过计算机对透射和反射白光灯进行强度调整 。
13.滤色镜片:标配590nm(EB/Gel Red/Biosafe/Gelsafe)
14.滤光片位置: 6位电脑控制自动定位滤光片轮 。
15.定时关机: 0-60分钟定时关机功能 。
16.拍摄面积:紫外:18 × 18 cm 白光:16 × 16 cm 。
17.软件:专业凝胶图像采集分析处理软件
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 206-201-001 | BG-gdsAUTO720化学发光凝胶成像系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
BG-gdsAUTO320凝胶成像系统
BG-gdsAUTO320
应用范围:可用于DNA/RNA凝胶、蛋白质凝胶、印迹杂交膜放射自显影胶牌、酶标板、薄层层析板、培养皿的成像及分析。
软件功能:
1.用于蛋白质泳道分析、DNA/RNA分子量计算、单一条带分析、 Dot-blot电泳分析,菌落计数-培养皿计数,测量面积/密度、 印迹杂交膜放射自显影胶牌、 酶标板、薄层层析板;
2.能够自动识别和手动识别泳道/条带,并对泳道/条带编号,调整泳道(增加/删除),具有泳道矫正功能;
3.全自动控制功能:通过软件实现对图像处理及采集功能直接操作;
4.图像处理功能:调整图像大小、调整亮度、调整灰度、调整对比度、图像旋转、图像反色、图象裁切、图象缩放;
5.数据结果与MS Excel无缝联接;
6.软件终身免费升级。
1.内置电脑,无需另配。
2.数码高分辨率低照度积分摄像头,有效像素:1280 × 1024(130万)。
3.数据处理系统:工业ITX系列主板 。
4.低功耗处理器,双核1.8G,固态硬盘,128G容量,Windows系统。
5.预览显示:日本三菱 12.1寸工控液晶屏,分辨率 1024 × 768。
6.带有触摸屏,触控灵敏,无线键鼠套装,配有标准网口、USB,COM、VGA。
7.检测灵敏度:可测出低至 0.02 ng 的核酸。
8.像素点大小:5.2 × 5.2 μm 。
9.机箱面板控制:可通过机箱面板进行变焦、聚焦、光圈、透射紫外灯及反射灯的全自动控制。
10.电脑控制:高度程序化(电脑控制暗箱/电源/紫外及白光灯的开关/光圈/焦距)。
11.割胶装置:专用观察和割胶装置(可视角度与物体为90°)。
12.镜头:采用日本Computer高通透自动变焦镜头 8-48 mm,根据要求随意缩放凝胶尺寸。
13.滤色镜片:专为多种荧光染料凝胶成像特性研制的镀膜滤镜UV/IR590nm。
14.定时关机:15分钟定时关机功能,有效延长紫外灯管和紫外玻璃的使用寿命。
15.开门:抽屉式开门载样台。
16.白光透射:特制的紫外转换白光板。
17.透射波长:312 nm(254 nm、365 nm为选配件)。
18.载样板尺寸:紫外透射 20 × 25 cm、白光透射 21 × 26 cm。
19.分析软件:Gel Image Analysis
| 货号 | 名称 | 描述 | 购买 |
|---|---|---|---|
| 206-160-001 | BG-gdsAUTO320凝胶成像系统 | 咨询客服 |
| 货号 | 名称 | 品牌 | 购买 |
|---|
|
品牌:Sanplatec
CAS No.: 储存条件:室温 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
WEB28540 |
– | 1 EA | – | 咨询 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司。