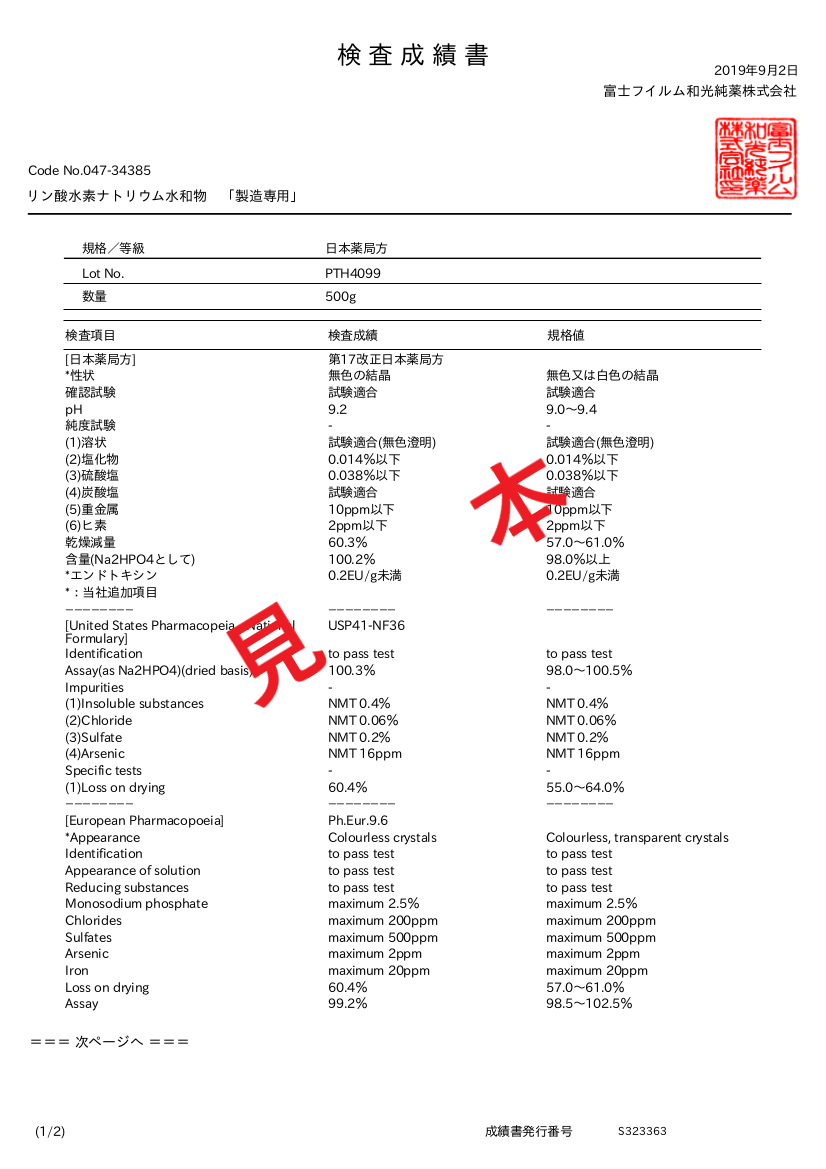
- 产品特性
- 相关资料
- Q&A
- 参考文献
用于医药品崩坏试验、溶出试验的试剂![]()
已调配好用于医药品崩坏试验、溶出试验的试剂。和光提供一般浓度和10倍浓度的产品。采用低溶出型容器,更适合用于溶出试验。以下依次为各种新出试剂。没有列出的其他PH值的试剂也可以根据客人需要调配。如有需要,请与我们联系。
◆优点
1、 使用低溶出类型的容器
2、 提供原材料的质量检验报告
3、 PH值在规定值±0.05以内(25℃)
4、 保质期明确记于标签
5、 使用防假冒、有防止脉动功能的高纯度药品专用清洁瓶
6、 在严格管理的清洁环境下生产
以上没有列出的pH值的溶剂也可根据客人需要配制,详细情况请咨询。
医药品崩坏试验·溶出试验用试剂 调配方法:按以下配比调配
● 崩坏试验第1试剂。pH1.2/溶出试验第1试剂。pH1.2 ※日本药典标准
● 将2.0 g氯化钠于7.0 mL盐酸中溶解并加入水稀释至1000 mL,液体无色透明,pH值大约1.2。
● 崩坏试验第2试剂 ※日本药典标准
● 将0.2 mol/L氢氧化钠溶剂118 mL加入0.2 mol/L磷酸二氢钾溶液250 mL中,并加入水稀释至1000 mL,溶液无色透明,pH大概6.8。
● 溶出试验第2试剂※日本药典标准
● pH6.8磷酸盐缓冲液1:1加入水
● 磷酸盐缓冲液 pH6.8 ※日本药典标准
● 加水溶解磷酸二氢钠3.40g及无水磷酸氢二钠3.55 g并稀释至1000 mL。
● 醋酸·醋酸钠缓冲液 pH4.0 ※日本药典标准
● 用900 mL水溶解三水醋酸钠5.44 g,滴加醋酸(100),pH调至4.0后加水稀释至1000 mL。
● 稀释McIlvaine缓冲液 厚生劳动省 通知标准
● 用0.025 mol/L柠檬酸和0.05 mol/L磷酸氢二钠调整pH。
崩解和溶出实验用缓冲溶液
for Disintegration and Dissolution Test
崩解度是固体药物的质量检查的指标之一,崩解度是药物在人体(胃)崩解速率的一个度量横值,取决于崩解剂。一般用崩解时限考察。依靠崩解时限检查作为所有片剂、胶囊等固体制剂在体内吸收的评定标准显示然是不够完善的,因为药物溶解后通过崩解仪筛网粒径常在1.6-2.0 mm之间,而药物需呈溶液状态才能被机体吸收,所以崩解仅仅是药物溶出的最初阶段,而后面的继续分散和溶解过程,崩解时限检查是无法控制的。
固体制剂出现了溶出度的概念,也称溶出速率,是指在规定的溶剂和条件下,药物从片剂、胶囊剂、颗粒剂等固体制剂中溶出的速度和程度。测定固体制剂溶出度的过程称为溶出度试验,它是一种模拟口服固体制剂在胃肠道中的崩解和溶出的体外试验方法。药物溶出度检查是评价制剂品质和工艺水平的一种有效手段,可以在一定程度上反映主药的晶型、粒度、处方组成、辅料品种和性质、生产工艺等的差异,也是评价制剂活性成分生物利用度和制剂均匀度 的一种有效标准,能有效区分同一种药物生物利用度的差异,因此是药品质量控制必检项目之一。
Wako能提供专用于崩解和溶出实验的缓冲溶液(级别:for Disintegration and Dissolution Test)。
◆产品信息
1. 这些缓冲溶液可用于医药的崩解和溶出度检测实验中。此试剂通过严格的控制,可以直接用作溶出介质,无需再配置缓冲溶液。
此产品是根据日本厚生劳动省颁布的以下文件制备的。
2. 仿制药生物等效性实验指导原则。
3. 处方药质量重新评价的初步实验。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| 061-06371 | 崩坏试验第1试剂pH1.2/溶出试验第1试剂 pH1.2 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 069-06377 | 崩坏试验第1试剂pH1.2/溶出试验第1试剂 pH1.2 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 068-06381 | 崩坏试验第2试剂 pH6.8 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 066-06387 | 崩坏试验第2试剂 pH6.8 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 065-06391 | 溶出试验第2试剂 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 063-06397 | 溶出试验第2试剂 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 163-26701 | 磷酸盐缓冲液 pH6.8 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 161-26707 | 磷酸盐缓冲液 pH6.8 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 016-25741 | 醋酸•醋酸钠缓冲液 pH4.0 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 014-25747 | 醋酸•醋酸钠缓冲液 pH4.0 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 018-25941 | 醋酸•醋酸钠缓冲液0.05mol/L pH4.0 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 016-25947 | 醋酸•醋酸钠缓冲液0.05mol/L pH4.0 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 044-33491 | 稀释McIlvaine缓冲液 pH3.0 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 042-33497 | 稀释McIlvaine缓冲液 pH3.0 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 047-33501 | 稀释McIlvaine缓冲液 pH4.0 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 045-33507 | 稀释McIlvaine缓冲液 pH4.0 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 044-33631 | 稀释McIlvaine缓冲液 pH4.5 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 042-33637 | 稀释McIlvaine缓冲液 pH4.5 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 044-33511 | 稀释McIlvaine缓冲液 pH5.0 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 042-33517 | 稀释McIlvaine缓冲液 pH5.0 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 041-33521 | 稀释McIlvaine缓冲液 pH6.8 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 049-33527 | 稀释McIlvaine缓冲液 pH6.8 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 048-33531 | 稀释McIlvaine缓冲液 pH7.5 | 5 L | 医药品溶出试验、崩坏试验用品 |
| 046-33537 | 稀释McIlvaine缓冲液 pH7.5 | 10 L | 医药品溶出试验、崩坏试验用品 |
| 066-06441 | 崩坏试验第1试剂 pH1.2/溶出试验第1试剂 pH1.2(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |
| 063-06451 | 崩坏试验第2试剂 pH6.8(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |
| 161-26981 | 磷酸盐缓冲液 pH6.8(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |
| 011-25931 | 醋酸•醋酸盐缓冲液pH4.0(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |
| 046-33711 | 稀释McIlvaine缓冲液 pH6.0(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |
| 043-33721 | 稀释McIlvaine缓冲液 pH6.5(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |
| 040-33731 | 稀释McIlvaine缓冲液 pH7.0(X10) | 5 L | 医药品溶出试验、崩坏试验用品 |