- 产品特性
- 相关资料
- Q&A
- 参考文献
脑组织冻存液
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |

人来源细胞冻存液
iStock

◆比较LYMPHOTEC目前使用的含血清冻存液与iStock的性能
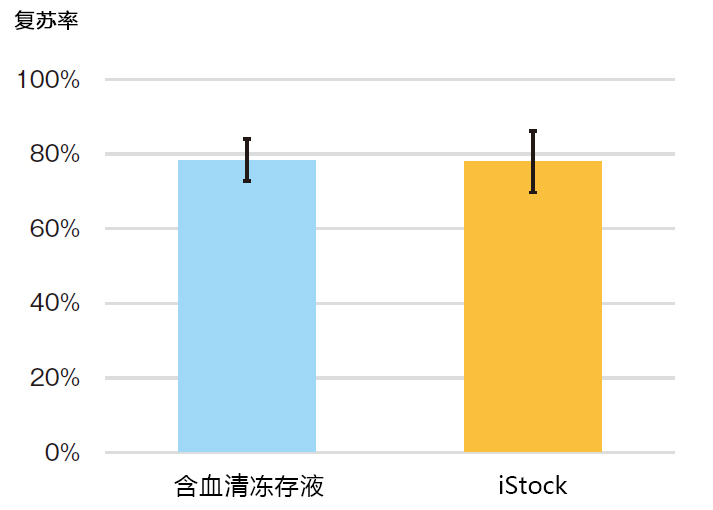
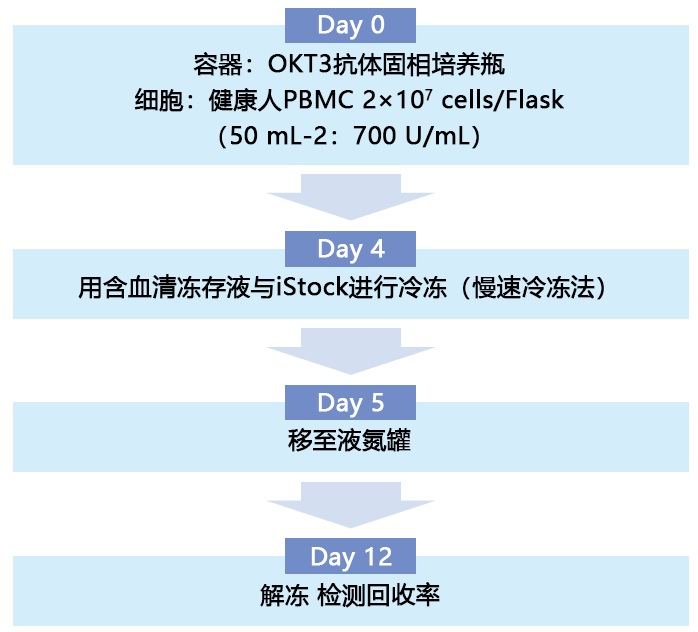
从 9 名知情同意的健康者血液中,分离出外周血单核细胞(PBMC),并使用OKT3抗体固相培养瓶和LYMPHOTEC本公司的淋巴细胞培养基培养4天。使用含血清冻存液和iStock,将增殖的细胞制备成1.5×107 cells/mL,采用慢速冷冻法,冷冻于-80℃。第二天,转移至液氮罐中,保存7天后解冻,比较回收率(解冻后细胞数/冷冻前细胞数×100%)。
◆iStock使用方法
◆规格
适用细胞:◯人免疫细胞 ◯人间充质干细胞 ◯人iPS细胞
保存条件:冷藏、避光、2-10℃
无菌检查:◯内毒素:显色法 ◯支原体:培养法 ◯真菌、细菌:琼脂平板表面涂抹法
操作步骤:
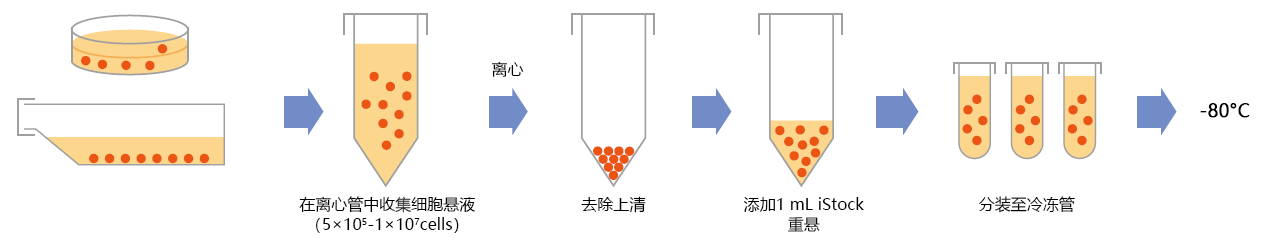
1. 细胞冻存
❶将细胞移至离心管。
❷离心分离(800×g左右,3-5 min),用抽吸器去除上清。向~1.5×107个细胞中加入1 mL的 iStock,缓慢地进行移液。
❸将细胞悬液分注至冷冻管中。
❹在-80℃的低温冷冻箱进行冻存(根据细胞类型,将冷冻管转移至市售的冷冻容器进行冻存)。
❺第二天移至液氮罐中。
2. 细胞解冻
❶在37°C的温水浴中解冻冷冻管。
❷立即与约10 mL的培养液混合。
❸离心分离(800×g左右,3-5 min),用抽吸器去除上清。
❹在适量的培养液中悬浮,转移至培养容器,开始培养。
注意事项:
◯请勿用于人体。
◯本产品未获得医药用品的相关许可证明。
◯在使用前,先对使用的细胞进行确认测试。
◯对于因本产品的使用问题造成的任何事故或损坏,本公司概不负责。
◯使用上如有疑问,请联系(株)LYMPHOTEC。
点击此处下载产品宣传页
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| 385-19451 | iStock | 120 mL | – |
即用型![]()
脑组织冻存液
本品是冷冻保存大鼠或小鼠胚胎脑组织用的冻存液。
只要将脑组织放入解冻后的本品中即可实现冻存。
冻存的脑组织在解冻后可通过神经细胞分散溶液(产品编号:291-78001,297-78101)和神经细胞培养基(产品编号:148-09671)进行分散和培养。
◆特点
● 能冻存解剖后的大鼠或小鼠的脑组织。
● 随时可用
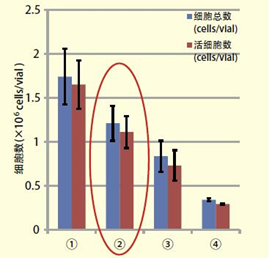
◆冻存数据:大鼠海马体(胎生19日)
|
总细胞数(cells/vial) |
活细胞数(cells/vial) |
活细胞比例(%) |
活细胞数比 |
||
|
① |
未经冻保 |
1.74×106 |
1.65×106 |
95 |
1 |
|
② |
脑组织冻存液(本品) |
1.21×106 |
1.11×106 |
92 |
0.67 |
|
③ |
本公司的冻存液(通用动物细胞用) (含有血清成分) |
8.34×105 |
7.29×105 |
87 |
0.44 |
|
④ |
其他公司的冻存液(通用动物细胞用) (含有血清成分) |
3.40×105 |
2.91×105 |
86 |
0.18 |
与其他公司的产品相比,在使用本品保存的脑组织中,能获得多3倍以上的活细胞。
注意事项
请尽量缩短从开始解剖到一次冷冻开始的时间。(请以从进行动物麻醉到将脑组织放入冷冻保存溶液中的时间控制在1小时之内为标准。)从胚胎中取出的细胞存活率随时间的推移而下降。使用神经细胞分散液能去除死亡细胞,减少得到的细胞总数。冰上操作。
◆实验方案例子
解剖
1. 麻醉小鼠或大鼠。
2. 用70%乙醇对麻醉动物进行全身(包括胡须和尾巴)消毒。
3. 用不锈钢盘将动物送入铺好无尘纸的清洁区。
4. 从妊娠动物中取出胚胎,放入含有L-15溶液的培养皿中。预先将培养皿与L-15溶液的温度调节到4℃。将盛放胚胎的培养皿至于冰块上。
4. ※L-15溶液:含有终浓度为0.05 mg/mL硫酸庆大霉素的Leibovitz's L-15培养基
5. 将胚胎转移到培养皿的盖子上,并使用显微镜快速移除脑组织。
6. 解剖后的脑组织放入另一个装有L-15溶液的培养皿,再将培养皿放置到冰块上。
一次冷冻
1. 将从冰箱中取出本品和冷冻用碎冰盒放到清洁区附近。
2. 用镊子把冷冻的脑组织放入本品中,盖好试管盖(放入脑组织前要充分混合保存溶液)。
3. 将试管埋入冷冻用碎冰盒中,试管与冰块要紧密接触(试管要埋入试管盖刚好露出冰面的位置)。
4. 盖上泡沫箱,静置90分钟。
二次冷冻
1. 一次冷冻后,将装有组织的试管转移至防冻套管,然后立刻放入超低温冰箱(-80℃)。(防冻套管要直接放置到冰箱内的底面。)
1. ※为了将装有组织的试管的温度变化控制在最小范围,操作时动作要快速。
1. ※进行这一步操作时,需注意样品管盖切勿与保存溶液相接触。
2. 在超低温冰箱(-80℃)中静置3小时。(静置时间可延长30分钟左右。但不能少于3小时。)
2. ※期间避免反复开关冰箱门。
保存
1. 二次冷冻后,将装有组织的样品管置于冻存架上,然后立刻放入液氮罐中。
1. ※进行这一步操作时,需注意样品管盖切勿与管内的保存溶液相接触。
◆产品列表
|
产品编号 |
产品名称 |
规格 |
包装 |
|
029-19161 |
Brain Tissue Freezing Medium |
细胞培养用 |
1 mL×10 |
◆相关产品
培养基
|
产品编号 |
产品名称 |
规格 |
包装 |
|
148-09671 |
Neuron Culture Medium |
细胞培养用 |
100 mL |
神经细胞用分散液
|
产品编号 |
产品名称 |
规格 |
包装 |
|
291-78001 |
Neuron Dissociation Solutions |
细胞培养用 |
4 set |
|
297-78101 |
Neuron Dissociation Solutions S |
细胞培养用 |
10 set |
已知组成培养基/补充剂
|
产品编号 |
产品名称 |
规格 |
包装 |
|
148-09615 |
NS Basal Medium |
细胞培养用 |
500 mL |
|
146-09351 |
NS Supplement(×50) |
细胞培养用 |
10 mL |
|
149-09721 |
NS Supplement without Insulin(×50) |
细胞培养用 |
10 mL |
|
145-09723 |
50 mL |
||
|
142-09691 |
NS Supplement without Vitamin A(×50) |
细胞培养用 |
10 mL |
|
141-09041 |
N2 Supplement with Transferrin(Apo)(×100) |
细胞培养用 |
5 mL |
|
141-08941 |
N2 Supplement with Transferrin(Holo)(×100) |
细胞培养用 |
5 mL |
|
073-05391 |
200 mmol/L L-Glutamine Solution (×100) |
细胞培养用 |
100 mL |
※ 本页面产品仅供研究用,研究以外不可使用。
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
可用于iPS细胞的冷冻保存!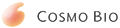
培养细胞冻存液COS banker系列
COS banker是不含血清和牛来源化合物的安全培养细胞冻存液。
COS banker II是为了保存过继免疫淋巴细胞而开发的淋巴细胞冻存液。
◆特点
● 可以冷冻保存iPS细胞。
● 无需稀释使用。
● 复苏后的细胞存活率优异。
● "COS banker"不含动物的血清以及其他动物源成分。*1
● 为了防止其中的DMSO腐蚀PET容器,特意采用玻璃装瓶。
*1 "COS banker II"含有GMP级人血清白蛋白的稳定剂。

◆实验步骤
1. 以转速1200 rpm/5 min对处于对数期*2的细胞进行离心操作,然后收集大约5×105~1×107个离心后的细胞。
2. 向细胞沉淀中添加1mL本产品,进行重悬后放进冻存管中,在-80°C冷冻保存。
3. 用液氮储存时,细胞请预先在-80°C下冷冻1天以上。
4. 复苏操作请在37°C的恒温水浴锅中快速进行。
*2 冻存的细胞需位于对数期,这点对于提高复苏后的存活率至关重要。
◆规格
|
产品名称 |
COS banker |
COS banker II |
|
产品编号 |
COS-CFM01 |
COS-CFM02 |
|
产品包装 |
120mL |
120mL |
|
成分 |
含DMSO(含量不公开) |
含DMSO(含量不公开) |
|
储存方法 |
低温避光保存(2~8°C) |
低温避光保存(2~8°C) |
|
有效期 |
生产后2年 |
生产后2年 |
◆质量控制
|
检查项目 |
测试方法 |
标准 |
|
无菌性 |
TGC、SCD以及培养法(日本药典) |
不生长 |
|
内毒素 |
动力学比色法(日本药典) |
0.3 EU/mL 以下 |
|
细胞保存性 |
冷冻7天后重新复苏的细胞生存 |
与对照冻存液相同 |
◆使用例子
|
COS banker |
iPS细胞(Dotcom)、 |
|
Daudi(人伯基特淋巴瘤)、HeLa S3(人宫颈癌)、 |
|
|
K562(人慢性骨髓性白血病)、Raji(人伯基特淋巴瘤)、 |
|
|
MOLT-4(人急性淋巴细胞白血病 : T- 细胞)、 |
|
|
CTLL-2(小鼠T : IL-2 依赖性)、NIH/3T3(小鼠胎儿)、 |
|
|
PC-12(大鼠肾上腺嗜铬细胞瘤)、CHO-K1(中国仓鼠卵巢)、 |
|
|
Vero细胞(非洲绿猴肾来源细胞株)、 |
|
|
MDCK细胞(犬肾小管上皮细胞来源的细胞株) |
|
|
MCF-7(人乳癌) 、HepG2(人肝癌)、 |
|
|
P3U1(小鼠骨髓瘤)、成纤维细胞、 |
|
|
表皮角化细胞、血管内皮细胞、杂交瘤、SF9(昆虫细胞) |
|
|
COS banker II |
人末梢血来源活化淋巴细胞、 |
|
Daudi细胞、Raji细胞、K652细胞、 |
|
|
Molt-4F细胞、CTLL-2细胞、MCF-7(人乳癌)、 |
|
|
HepG2(人肝癌)、P3U1(小鼠骨髓瘤)、 |
|
|
成纤维细胞、表皮角质形成细胞、血管内皮细胞、 |
|
|
杂交瘤、CHO细胞(中国仓鼠卵巢来源细胞株)、 |
|
|
MDCK细胞(犬肾小管上皮细胞来源的细胞株)、HeLa(人宫颈癌)、SF9(昆虫细胞) |
◆iPS细胞
【冷冻保存程序(缓慢冻结法)】
● 用CTK溶液回收细胞
● 离心(1000 rpm,5分钟),除去上清液
● 添加COS banker,重悬细胞
● 分装到冻存管中
● 将冻存管放入冻存盒中。
● 置于-80℃的超低温冰箱中
● 次日将冻存管移至液氮中
|
|
|
图1 iPS细胞(Dotcom)的冻存结果
左:复苏后第二天、 右:复苏后第六天
◆人淋巴细胞
|
|
|
图2 (左图)不同细胞冻存液的细胞存活率比较
添加0.5 mL细胞(活细胞浓度 3×106 cells/mL)至冻存管,并储存在-80°C中。一周/一个月/两个月后复苏(在37°C恒温水槽中孵育90秒,剩余的冷冻细胞摇晃融解),测量存活率。
灰:一周后、 蓝:一个月后、 黑:2个月后
图3(右图)复苏后的细胞增殖情况
复苏冻存了一周的淋巴细胞,将各个培养基的活细胞浓度调至20×104 cells/mL,在水浴锅中培养。对第5天及第6天的活细胞进行计数。
◆产品列表
COS banker
不含血清和牛来源化合物的安全培养细胞冻存液。
|
产品编号 |
制造商 |
产品名称 |
包装 |
|
COS-CFM01 |
KOJ |
COS banker [Cell Freezing Medium] (chemical defined) |
120 mL |
COS banker II
为了保存过继免疫淋巴细胞而开发的淋巴细胞冻存液。
|
产品编号 |
制造商 |
产品名称 |
包装 |
|
COS-CFM02 |
KOJ |
COS banker II [Cell Freezing Medium] |
120 mL |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
通用动物细胞的冻存液
CultureSure无血清细胞冻存液
本品是适用于冻存动物细胞的无血清细胞通用冻存液。
利用缓慢冻存法冻存细胞,细胞复苏活率高。
另外,本品含有BSA和DMSO。
◆特点
● 是具有与含血清产品同等功能的无血清冻存液
● 能通过缓慢冷冻法进行冻存
● 可长期存放在-80℃
● 无需配制试剂
◆质量检测项目
● 无菌检测
● 内毒素检测
● 支原体检测
◆使用方法
1. 冻存
① 用试管收集细胞。
② 离心去除上清。
③ 往试管中加入本品,重悬细胞。
④ 将悬浮液分注到保存用试管。
⑤ 将保存用试管在-80℃中冻存一晚。
⑥ 存放于-150℃或-80℃。
2. 细胞复苏
① 用37℃的水浴锅解冻冻存的试管。
② 在培养使用的培养基中进行悬浮。
③ 离心去除上清后在培养基中进行重悬。
④ 细胞铺板。
◆冻存数据①:-150℃,2个月
★维持与含血清冻存液同样的细胞存活率。
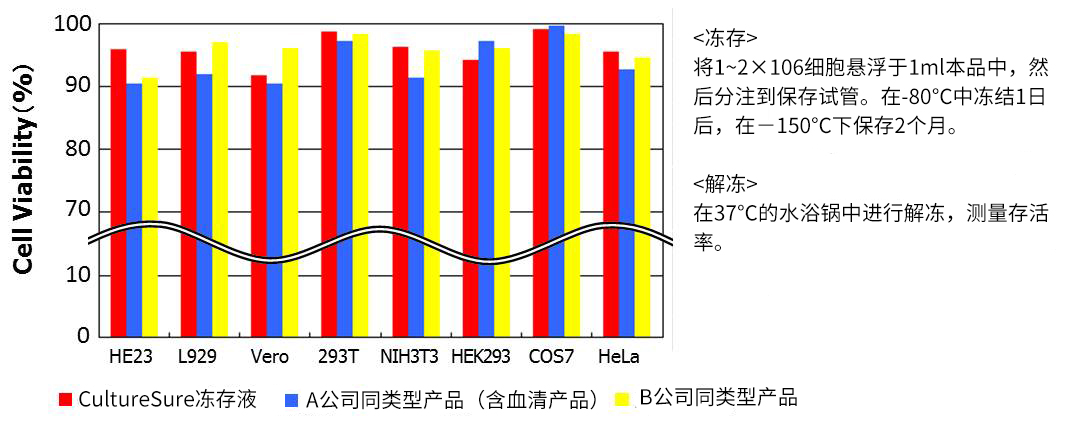
◆冻存数据②:-150℃,30个月
★细胞保存长达30个月仍保持高存活率。
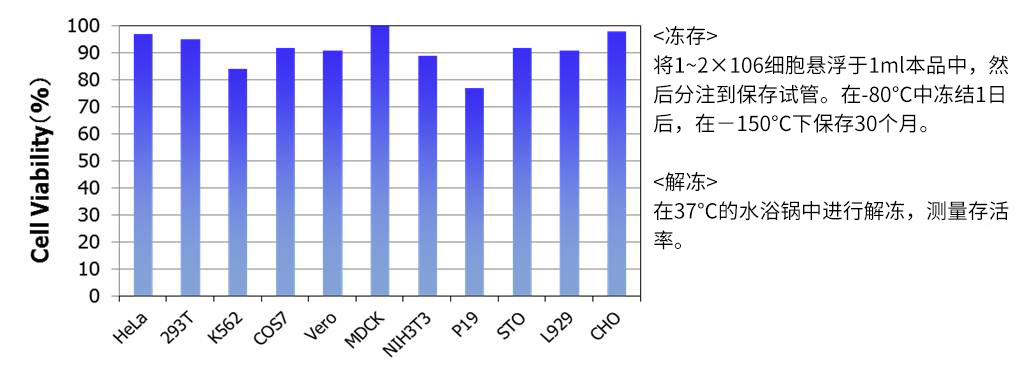
◆冻存数据③:-80℃,1个月
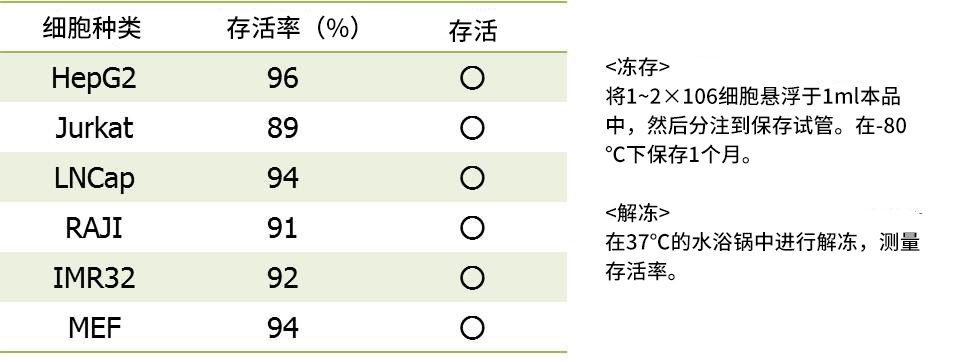
◆产品列表
|
产品编号 |
产品名称 |
等级 |
包装 |
|
039-23511 |
CultureSure Freezing Medium |
细胞培养用 |
100 mL |
◆相关产品
★液体培养基・细胞培养用试剂★
液体培养基、平衡盐溶液、细胞剥离・分散用溶液、抗生素,细胞外基质等产品陆续上市。
★StemSure® 冻存液★
适合冻存小鼠ES细胞或人iPS细胞的细胞保存溶液。
|
产品编号 |
产品名称 |
等级 |
包装 |
|
195-16031 |
StemSure Freezing Medium |
细胞培养用 |
100 mL |
以上产品仅供实验・研究使用,不可用作“医药品”、“食品”或“家庭用品”。
更多产品资料请点击文字:CultureSure® 无血清细胞冻存液
欢迎下载电子版,或联系客服或当地经销商索取纸质版单页
参考文献
|
1. |
Kusakisako, K., Masatani, T., Yada, Y., Talactac, M. R., Hernandez, E. P., Maeda, H., … & Tanaka, T. (2016). Improvement of the cryopreservation method for the Babesia gibsoni parasite by using commercial freezing media. Parasitology international, 65(5), 532-535. 全文 |
|
2. |
Shirozu, T., Soga, A., & Fukumoto, S. (2020). Identification and validation of a commercial cryopreservation medium for the practical preservation of Dirofilaria immitis microfilaria. 全文 |
|
3. |
Lai, Y. C., Ushio, N., Rahman, M. M., Katanoda, Y., Ogihara, K., Naya, Y., … & Sunaga, T. (2018). Aberrant expression of microRNAs and the miR‐1/MET pathway in canine hepatocellular carcinoma. Veterinary and comparative oncology, 16(2), 288-296. 全文 |
|
4. |
Rahman, M. M., Lai, Y. C., Husna, A. A., Chen, H. W., Tanaka, Y., Kawaguchi, H., … & Miura, N. (2019). Aberrantly expressed snoRNA, snRNA, piRNA and tRFs in canine melanoma. Veterinary and Comparative Oncology. 全文 |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |

高存活率细胞冻存液
CryoScarless® DMSO-Free
CryoScarless® DMSO-Free 是一款不含蛋白和 DMSO,适用于多种细胞的细胞冻存液。各种细胞在解冻后具有很高的培养活率,且维持了干细胞的多分化性(未分化状态)。
※ 本产品仅供科研,不可用于科研外其他用途。
◆关于含有DMSO冻存液的问题
DMSO作为普通细胞冷冻保护成分常被添加到冻存液中,但同时也是对人体有害的成分,且极易被皮肤吸收。除具有细胞毒性外,如同下列论文所述,是影响细胞分化的因子之一。因此,为获得更精确的实验结果,无DMSO的细胞保存是必须的。
● 使用DMSO将人骨髓白血病细胞株 HL-60 分化为粒细胞。1
● 使用DMSO将小鼠间充质干细胞分化为心肌细胞。 2
● 使用含有DMSD的冻存液冻存人ES细胞发现未分化标记Oct-4的表达降低。 3
参考文献
1. Jiang, G., et al., Int. Immunopharmacol., 6 (7), 1204~1213 (2006).
2. Young, D. A., et al., Biochem. Biophys. Res. Commun., 322 (3), 759~765 (2004).
3. Katkov, I. I., et al., Cryobiology, 53 (2), 194~205 (2006).
◆特点
● 不含血清和蛋白,因此不受白蛋白和球蛋白等蛋白的影响。
● 不受DMSO毒性和蛋白影响,可安全且高活率地冻存细胞。
● 大部分细胞在冻存后复苏,存活率可达90%以上。
● 已有人/小鼠的正常细胞、肿瘤细胞株、干细胞等各种细胞的冻存应用。
● 冻存后可维持干细胞的分化性能。
● 同样适用于无血清培养。
● 经无菌测试确认不含细菌、真菌与支原体污染。
● 本产品可在4°C下长期保存。(有效期2年)。
※ 使用台盼蓝处理CryoScarless保存的细胞时,请务必清洗细胞。
◆应用实例1
大鼠间充质干细胞分化能力
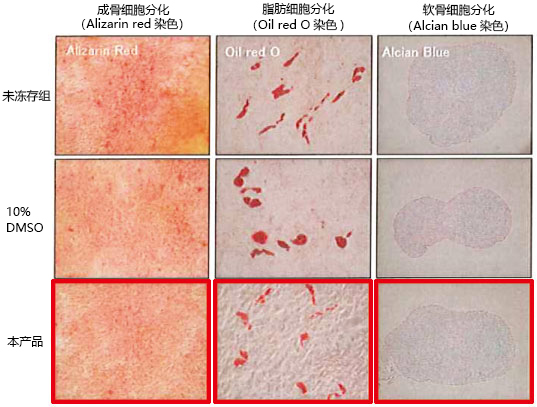
确认使用本产品冻存的大鼠间充质干细胞在复苏后的分化能力,并与未冻存组以及10% DMSO保存的细胞进行比较。结果显示,使用本产品冻存的细胞皆维持良好的分化性能。
大鼠间充干细胞的存活率
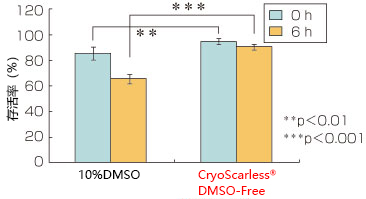
检测使用本产品冻存(1周)的大鼠间充质干细胞在复苏后的存活率以及 6 h后的存活率,并与10% DMSO保存的情况进行比较。本产品无论是在刚复苏(0 h),还是贴壁后(6 h)皆显示更高的存活率。
◆应用实例2
使用 CryoScarless® DMSO-Free 简单冻存后的小鼠 ES 细胞
实验方法:
将小鼠 ES 细胞(FKHR+/+)在明胶包被的96孔板上于37°C培养48 h后,进行简单地冻存。吸走培养基并用PBS清洗,然后分别添加10%DMSO/培养基,或CryoScarless® DMSO-Free,在-80°C下保存。24 h后迅速复苏,添加加热至37°C的培养基,在37°C下继续培养。6 h后使用光学显微镜观察相衬图像。

结果:
可观察到在10%DMSO/培养基中保存的小鼠ES细胞在复苏后活细胞减少(左图),而在 CryoScarless® DMSO-Free 中保存的小鼠ES细胞状态得到改善,可观察到大部分的活细胞。
讨论:
在对多个转基因克隆的培养板一起进行冻存时(简易冻存),使用CryoScarless® DMSO-Free 更加方便。利用 CryoScarless® DMSO-Free 进行冻存,存活细胞更多,更易于未分化小鼠ES细胞的传代培养(在一定细胞密度下每2天传代一次),并可顺利进行分化实验。
数据提供
熊本大学发育医学研究所 干细胞部门 组织干细胞领域 田村洁美老师

小川峰太郎老师(组织干细胞领域教授:中间),田村洁美老师(右起2)与研究室成员
◆应用实例3
对于人牙髓来源间充质干细胞的体内实验,CryoScarless® DMSO-Free 拥有更出色的冻存能力
日本牙科大学生命牙学部 发育、再生医科讲座 中原贵教授
生命牙科学讲座 望月 真衣 助教
Establishment of xenogeneic serum-free culture methods for handling human dental pulp stem cells using clinically oriented in-vitro and in-vivo conditions.
Stem Cell Research & Therapy,, 9:25, (2015).
背景
由于再生医学不断普及,因此急需确立可安全地培养从患者获得的间充质干细胞的方法。近年来,通过牙科治疗从拔牙的牙组织(牙髓)中获得的间充质干细胞,显示比骨髓干细胞高3~4倍的高增殖性,且没有伴随染色体异常的细胞变化。而且牙髓干细胞拥有与骨髓干细胞相同的多分化性能。由于在体外培养可大量增殖,灵活利用低癌变和成瘤风险的牙髓干细胞,对于确保医疗安全性的再生医学来说是一个极具吸引力的选择。
作为再生医学中必不可少的"细胞冻存",已经证明CryoScarless® DMSO-Free(BioVerde公司)是一款优秀的细胞冻存液。换言之,使用该细胞冻存液冻存的人牙髓干细胞拥有与未经冻存培养的牙髓干细胞相同的增殖能与多分化能力,且未发现染色体异常。
本文着眼于牙髓干细胞活跃的增殖能力,并证实了CryoScarless® DMSO-Free不会影响细胞增殖能力。
方法及结果
从20~37岁成人拔下来的智齿分离牙髓细胞并进行无血清培养,培养至传代数为1时使用CryoScarless® DMSO-Free冻存。3个月后再次培养冻存的细胞,传代数到3时进行以下的细胞评价。同时,对未经冻存的牙髓细胞也进行了相同的评价。
使用相差显微镜观察细胞形态,确认纺锤形的成纤维细胞形态没有发生变化(图-1)。根据增殖曲线分析的结果,经过12天的培养,呈现一致的细胞增殖模式,两者间在统计学上的没有显著差异(图-2)。另外,通过Bromodeoxyuridine(BrdU)进行细胞分裂能力分析的结果显示,可观察到对数生长期内大量的BrdU阳性细胞,细胞数在统计学上没有显著差异(图-3)。

图-1 人牙髓干细胞的相差显微镜图像
无论CryoScarless® DMSO-Free冻存(左)还是未经冻存(右)的细胞都呈现出相同的成纤维细胞样形态。

图-2 人牙髓干细胞增殖曲线分析
细胞培养期间,未发现两者在统计学上的显著差异。

图-3 人牙髓干细胞在对数生长期内的BrdU分析
可观察到大部分细胞摄入BraU(绿)(左),未发现两者的BraU阳性细胞数在统计学上的显著差异(右)。
结论
除了本文中报告的细胞增殖能力评价之外,使用CryoScarless® DMSO-Free冻存的牙髓干细胞不仅维持了成骨细胞、脂肪细胞、软骨细胞的多分化能力,也能维持向免疫缺陷小鼠的皮下移植并引起硬组织形成的能力。并且该产品并不影响干细胞的特性。
另外,值得注意的是,使用CryoScarless® DMSO-Free冻存的牙髓干细胞即使长期培养至传代数为10后仍然保持染色体的二倍体和正常核型,大量培养的细胞中也没有发现染色体异常。
在再生医学中必不可少的"细胞冻存"中,作为冷冻保护剂使用的Dimethyl sulfoxide(DMSO)可能会有细胞毒性和引起意外的细胞分化,因此,我们十分期待能够确立一个像该产品一样的无DMSO的细胞冻存体系。
本报道中使用易于获得的牙髓来源间充质干细胞,研究了CryoScarless® DMSO-Free对干细胞特性的影响,并确认了使用该产品冻存的细胞与未经冻存的牙髓干细胞拥有相同的细胞特性。因此,CryoScarless® DMSO-Free在间充质干细胞基础研究以及临床前研究,甚至是将来的再生医学领域中,有望成为一款可以提供安全且高预测性数据和治疗成果的细胞冻存液。

中原贵教授(前排右),望月真衣助教(前排左)与研究室成员
◆实际应用的细胞和冻存效果
|
细胞株 |
存活率(%)* |
|
|
L929 |
小鼠成纤维细胞 |
97.5 ± 1.2 |
|
MG63 |
人骨肉瘤细胞 |
93.1 ± 2.3 |
|
HT1080 |
人纤维肉瘤细胞 |
90.2 ± 4.3 |
|
Colon26 |
小鼠结肠癌细胞 |
92.3 ± 2.3 |
|
B16F1 |
小鼠黑素瘤细胞 |
94.2 ± 0.6 |
|
KB |
人口腔癌细胞 |
91.8 ± 0.9 |
|
Caco2 |
人结肠癌细胞 |
93.7 ± 1.9 |
|
MC3T3 |
小鼠成骨细胞 |
94.4 ± 0.5 |
|
Jurkat E6-1 |
人白血病细胞 |
88.4 ± 2.5 |
|
HUVEC |
人脐静脉内皮细胞 |
89.9 ± 0.4 |
|
HCAEC |
人冠状动脉内皮细胞 |
90.1 ± 1.6 |
|
MEF |
小鼠胎儿成纤维细胞 |
94.4 ± 0.8 |
|
hACh |
人软骨细胞 |
93.5 ± 0.7 |
* -80°C冻存3个月,复苏后24 h
◆操作方法概要
1. 将培养细胞放入离心管,离心并去掉上清。
2. 按照5×105~5×106 cells/mL添加本产品,并制成细胞悬液,每个冻存管分装1 mL。
3. 放入-80℃超低温冰箱中冻存。
4. 将在上一步中保存的细胞放入37°C恒温水浴槽中,快速晃动使细胞解冻,融化后放入适当的培养基(10 mL)中并离心清洗。
※长期保存请置于液氮罐中保存。
◆产品列表
|
产品编号 |
产品名称 |
包装 |
|
CPL-A1 |
CryoScarless DMSO-Free |
100 mL |
◆相关产品
可检测细胞温度的荧光探针
Thermoprobe®
|
产品编号 |
产品名称 |
规格 |
|
FDV-0005 |
Cellular Thermoprobe for Fluorescence Ratio |
200 μg |
|
FDV-0005 |
3×200 μg |
|
|
FDV-0004 |
Cellular Thermoprobe for Fluorescence Lifetime |
200 μg |
|
FDV-0004 |
3×200 μg |
|
|
FDV-0002 |
Diffusive Thermoprobe |
100 μg |
|
FDV-0003 |
Particulate Thermoprobe |
100 μg |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| CPL-A1 | CryoScarless DMSO-Free 无DMSO细胞冻存液 |
100 ml | – |
BAMBANKER®
无血清细胞冻存液
|
BAMBANKER® 是一种无血清细胞冻存液。可在 -80℃ 长期保存细胞(肿瘤细胞和常规细胞)。 |
 |
◆产品特性
● 即用型细胞冻存液
● 无需分步降温,直接使用
● 无需稀释
● 无需程序降温盒
● -80℃ 长期保存
● 无血清
◆无血清冻存液的优点
● 与含血清类型相比,批次间的成分组成差异小,可保持稳定的品质。
● 不含血清,因此没有因动物源的未知成分和感染物质所产生的影响与风险。
● 可对无血清驯化细胞进行冷冻,节省再驯化步骤。
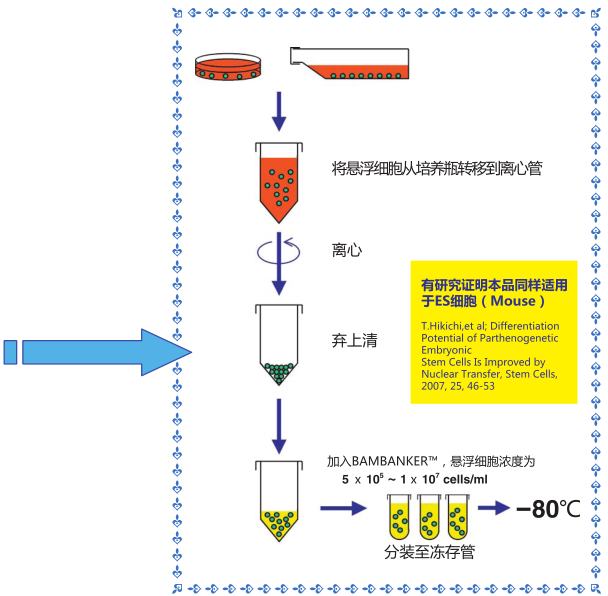
◆操作流程
1)收集生长对数期*的细胞(5×105-1×107个细胞)
2)用1mL 该细胞冻存液悬浮细胞,置于冻存管中,不需预冷,直接 -80℃ 冷冻保存,也可在-80℃冻存 12 小时后可
转移至液氮中保存。
3)用恒温箱或者水浴锅快速复苏细胞
*冷冻细胞必须处于生长对数期
◆无菌检测**
内毒素:生色底物法
支原体:荧光抗体法
真菌和细菌:依据日本药典
(**:可索取检验证书)
BAMBANKER® Direct
BAMBANKER Direct 是“无血清型”细胞冻存液。
◆BAMBANKER® Direct无需离心收集细胞
 ① 不需冻存前预处理,操作简便
① 不需冻存前预处理,操作简便
② 不需稀释,直接使用
③ 无需分步降温,直接使用
④ 可快速、长期冻存细胞(-80℃或液氮)
⑤ 不含血清
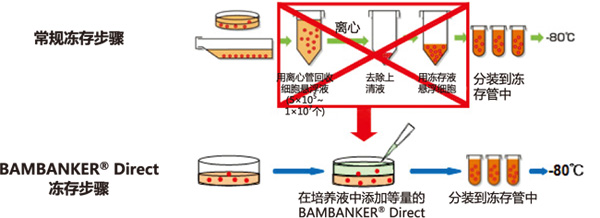
◆BAMBANKER® Direct冻存步骤VS常规冻存步骤
使用本产品无需经过离心等复杂步骤,只需往培养基内添加与培养液等量的 BAMBANKER Direct,再分装到冻存管,置于-80℃ 便可冻存细胞。
◆应用
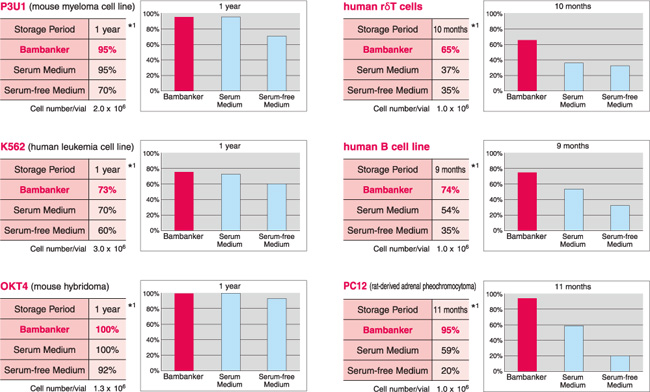
【BAMBANKER使用例】
| 细胞名称 | 保存时间 |
生存率 | ||
| BAMBANKER | 公司A(含血清) |
公司A(不含血清) |
||
|
P3U1 (小鼠骨髓瘤细胞系) |
12个月 |
95% | 95% | 70% |
|
K562 (人白血病细胞系) |
12个月 |
73% | 70% | 60% |
| 人体胃黏膜上皮细胞 | 10个月 |
100% | 62% | 56% |
|
human γδT cells (人γδT细胞) |
10个月 |
65% | 37% | 35% |
|
Daudi (人 B细胞系) |
12个月 |
100% | 100% | 92% |
|
PC12 (大鼠源肾上腺嗜铬细胞瘤) |
11个月 |
95% | 59% | 20% |
|
human B cell line (人B细胞系) |
9个月 |
74% | 54% | 35% |
|
OKT4 (小鼠杂交瘤细胞) |
12个月 |
100% | 100% | 92% |
|
B细胞系 (猴) |
10个月 | 56% | 40% | 18% |
【低温冻存实验证明以下细胞保存完好】
|
3T3‐L1(小鼠前脂肪细胞系) |
A431(人扁平上皮癌细胞系) |
BAEC(牛主动脉血管内皮细胞系) |
|
Balb/3T3(小鼠成纤维细胞系) |
C2C12(小鼠骨骼肌细胞系) |
Daudi(人B细胞系) |
|
ECV304(人脐静脉内皮细胞系) |
H295R(肾上腺皮质细胞) |
HEK293(人胚胎肾细胞系) |
|
HEK293T(人胚胎肾细胞系) |
HeLa(人子宫颈癌细胞系) |
HeLa S3(人子宫颈癌细胞系) |
|
HepG2(人肝癌细胞系) |
HFF(人正常成纤维细胞系) |
Huh7(人肝癌细胞系) |
|
Jurkat(人白血病T细胞系) |
K562(人慢性骨髓性白血病细胞系) |
KATOIII (人胃癌上皮细胞系) |
|
KLM‐1(人胰腺癌细胞系) |
MDCK(犬肾小管上皮细胞系) |
MEF(小鼠胚胎成纤维细胞) |
|
NIH3T3(小鼠胚胎皮肤细胞) |
OKT4(小鼠杂交瘤细胞) |
OP9(小鼠骨髓基质细胞) |
|
P3U1(小鼠骨髓瘤细胞系) |
PANC‐1(人胰腺癌细胞系) |
PC12(大鼠源肾上腺嗜铬细胞瘤) |
|
RPE(人视网膜上皮细胞系) |
SNL(小鼠胚胎成纤维细胞) |
TSU‐Pr1(人前列腺癌细胞系) |
|
Vero(非洲绿猴肾细胞系) |
human γδT cells (人γδT细胞) |
human B cell line (人B细胞系) |
| HDF(人皮肤成纤维细胞) | HCC20(人乳腺原发性导管癌细胞) | BMMCs(人骨髓单核细胞系) |
| BMMCs(猪骨髓单核细胞系) | BMSCs(马骨髓间充质干细胞系) | C1(人成纤维细胞系) |
| CEF(牛胚胎成纤维细胞) | CHO-K1(中国仓鼠卵巢细胞系) | DPCs(大鼠牙髓细胞) |
| DPCs(人牙髓细胞) | ESCs(人胚胎干细胞) | EVT(人绒毛外滋养层细胞) |
| GH3(大鼠垂体瘤细胞) | Gli36(胶质瘤细胞系) |
h1(人类胚胎干细胞) |
| h9(人类胚胎干细胞) | HN4(人口腔上皮细胞系) |
HS-RMS-2 (多形性横纹肌肉瘤细胞系) |
| IPS(人诱导性多能干细胞) |
LNCaP clone FGC (人前列腺癌细胞) |
MCF 10A(人正常乳腺细胞) |
|
MEF-BL/6-1 (小鼠胚胎成纤维细胞) |
MNCs(人单核细胞) | MSCs(大鼠间充质干细胞系) |
| PBMCs(人外周血单个核细胞) | PDL(人牙周膜细胞) | pES(大鼠孤雌胚胎干细胞系) |
| Sf9(草地贪夜蛾细胞系) | U251(胶质瘤细胞系) | U87(胶质瘤细胞系) |
| VT(人绒毛膜滋养层细胞) | 癌症干细胞 | 大鼠肝细胞 |
|
猴B细胞系 |
人外周血活化淋巴细胞 |
永生化人肌肉细胞 |
|
小鼠脾脏活化淋巴细胞 |
小鼠ES细胞系 |
人胃上皮细胞 |
| 大鼠神经祖细胞 | 大鼠脂肪细胞 | 狗肿瘤细胞 |
| 胶质瘤细胞系 | 牛脂肪细胞 | 牛子宫内膜上皮细胞 |
| 人扁桃体细胞 | 人肝细胞 | 人骨髓CD34+细胞 |
| 人巨噬细胞 | 人淋巴细胞 | 人输卵管上皮细胞 |
| 人胎儿卵巢成纤维细胞 | 人胎儿卵巢体细胞 | 人自然杀伤细胞 |
| 神经祖细胞 | 小鼠颅骨成骨细胞 | 心肌祖细胞 |
| 猪成纤维细胞 |
ES细胞(小鼠)使用实例
T.Hikichi,et al; Differentiation Potential of Parthenogenetic Embryonic Stem Cells Is Improved by Nuclear Transfer, Stem Cells, 2007, 25, 46-53
更多相关资料请点击文字:
BAMBANKER® 与自制冻存液的冻存效果比较
※ 本页面产品仅供研究用。研究以外不可使用。
Bambanker® 与其他相关产品的比较
细胞冻存效果验证
细胞冻存液类型
1.Bambanker®
2.Medium with serum (含血清,A公司)
3.Serum-free Medium (无血清,A公司)
实验结果
*1:细胞-80℃的保存时间
相关PDF
|
BAMBANKER® 无血清细胞冻存液 |
Wako BAMBANKER冻存液(新手册) 细胞种类列举 |
BAMBANKER细胞冻存液 –冻存解冻步骤说明 (终端).pdf |
|
1. |
Q:为什么我使用了 BAMBANKER® 来保存细胞,但是存活率依然不高? A:请冻存前确保细胞处于生长对数期,并且冻存时细胞数目控制在 5×105~1×107/mL 冻存液。 |
|
2. |
Q:我们实验室已经有固定的冻存程序了,换了你们的 BAMBANKER® 可以还继续用原来程序降温的方法冻存吗? A:虽然本产品可以无需程序降温冻存细胞,但如果通过程序降温盒等适当控制了温度下降的速度,效果更佳。 |
|
3. |
Q:哪些细胞株(系)适合使用BAMBANKER® 来进行细胞冷冻保存? A:几乎所有细胞株(系)都可以使用 BAMBANKER® 进行冻存。对于较为宝贵的 ES/iPS 细胞的保存尤其适用。官网上所列举的细胞系均已经过测试验证。 但也并不排除可能有某些细胞株是不适合使用 BAMBANER® 来进行冻存的,用户在没有确认是否可使用时,建议在进行正式细胞冻存之前先进行预实验。 |
|
4. |
Q:无血清冻存液相比传统含血清冻存液有什么优势? A:无血清冻存液因不含有动物血清,质量更稳定,批间差小;同时未知生物成分或感染性物质污染细胞的几率也极低,尤其对于 ES/iPS 细胞等有可能用于再生医疗的细胞安全得以严格保障;可以直接冻存无血清培养的细胞,免去无血清再驯化的步骤;另外 BAMBANKER® 无血清细胞冻存液不需要像传统的血清冻存液需要程序降温,减少了用户的繁琐操作,节省了时间。 |
|
5. |
Q:BAMBANKER® 在冷冻保存细胞的过程中起什么作用? A:BAMBANKER® 无血清细胞冻存液使用了 DMSO 等作为保护剂,在冻存细胞时能以1℃/min 左右的温度下降而逐渐冻结,在此过程中,细胞内的水分子被置换成冻结保护剂,抑制胞内和细胞周边的冰晶的形成,防止细胞膜和细胞器结构损伤,防止蛋白变质。 |
|
6. |
Q:未使用的BAMBANKER® 无血清细胞冻存液应该如何保存? A:2-10℃ 避光保存。开封后尽快使用。请注意保质期为自生产日期起 24 个月。 |
|
7. |
Q:BAMBANKER® 能否使用于医疗领域? A:BAMBANKER® 仅供科研使用,不能使用于人体或医疗领域。 |
BAMBANKER™参考文献
|
[1] |
Zhang C., Seo J., Nakamura T. (2018) Cellular Approaches in Investigating Argonaute2-Dependent RNA Silencing. In: Okamura K., Nakanishi K. (eds) Argonaute Proteins. Methods in Molecular Biology, vol 1680. Humana Press, New York, NY. |
|
[2] |
Sharma, A., M¨ucke, M., & Seidman, C. E. (2018). Human induced pluripotent stem cell production and expansion from blood using a non-integrating viral reprogramming vector. Current Protocols in Molecular Biology,122, e58. doi: 10.1002/cpmb.58. |
|
[3] |
Souta Motoike, Mikihito Kajiya, Nao Komatsu, et al. Cryopreserved clumps of mesenchymal stem cell/extracellular matrix complexes retain osteogenic capacity and induce bone regeneration. Stem Cell Res Ther. 2018; 9: 73. Published online 2018 Mar 21. doi: 10.1186/s13287-018-0826-0. |
|
[4] |
Konuma T1, Kohara C1, Watanabe E2, et al. Monocyte subsets and their phenotypes during treatment with BCR-ABL1 tyrosine kinase inhibitors for Philadelphia chromosome-positive leukemia. Hematol Oncol. 2018 Apr;36(2):451-456. doi: 10.1002/hon.2497. Epub 2018 Feb 12. |
|
[5] |
Srijaya Thekkeparambil Chandrabose, Sandhya Sriram, et al. Amenable epigenetic traits of dental pulp stem cells underlie high capability of xeno-free episomal reprogramming. Stem Cell Research & Therapy 2018 9:68. |
|
[6] |
Evans, Michael A. et al. "Macrophage-Mediated Delivery of Light Activated Nitric Oxide Prodrugs with Spatial, Temporal and Concentration Control." Chemical Science (2018): n. pag. Web. doi:10.1039/C8SC00015H. |
|
[7] |
Jauregui, C.; Yoganarasimha, S.; Madurantakam, P. Mesenchymal Stem Cells Derived from Healthy and Diseased Human Gingiva Support Osteogenesis on Electrospun Polycaprolactone Scaffolds. Bioengineering 2018, 5, 8. |
|
[8] |
Khamaikawin, Wannisa et al. Modeling Anti-HIV-1 HSPC-Based Gene Therapy in Humanized Mice Previously Infected with HIV-1. Molecular Therapy – Methods & Clinical Development , Volume 9,23-32. |
|
[9] |
Masako Okumura, Toyoaki Natsume, Masato T Kanemaki, Tomomi Kiyomitsu. Optogenetic reconstitution reveals that Dynein-Dynactin-NuMA clusters generate cortical spindle-pulling forces as a multi-arm ensemble. bioRxiv 277202; doi: https://doi.org/10.1101/277202 |
|
[10] |
https://labchem.wako-chem.co.jp/journal/docs/proup10.pdf<链接> |
|
[11] |
Ince T A, Aster J C. In vitro culture conditions for T-cell acute lymphoblastic leukemia/lymphoma: U.S. Patent 9,683,217[P]. 2017-6-20. |
|
[12] |
Morris C D, Azadnia P, de Val N, et al. Differential Antibody Responses to Conserved HIV-1 Neutralizing Epitopes in the Context of Multivalent Scaffolds and Native-Like gp140 Trimers[J]. mBio, 2017, 8(1): e00036-17.<链接> |
|
[13] |
Lee K, Saetern O C, Nguyen A, et al. Derivation of Leptomeninges Explant Cultures from Postmortem Human Brain Donors[J]. JoVE (Journal of Visualized Experiments), 2017 (119): e55045-e55045.<链接> |
|
[14] |
Buenrostro J D, Corces R, Wu B, et al. Single-cell epigenomics maps the continuous regulatory landscape of human hematopoietic differentiation[J]. bioRxiv, 2017: 109843.<链接> |
|
[15] |
Edmonds R E, Garvican E R, Smith R K W, et al. Influence of commonly used pharmaceutical agents on equine bone marrow‐derived mesenchymal stem cell viability[J]. Equine veterinary journal, 2017, 49(3): 352-357.<链接> |
|
[16] |
Jitraruch S, Dhawan A, Hughes R D, et al. Cryopreservation of Hepatocyte Microbeads for Clinical Transplantation[J]. Cell transplantation, 2017.<链接> |
|
[17] |
Usarek E, Barańczyk-Kuźma A, Kaźmierczak B, et al. Validation of qPCR reference genes in lymphocytes from patients with amyotrophic lateral sclerosis[J]. PloS one, 2017, 12(3): e0174317.<链接> |
|
[18] |
Gagnon E, Connolly A, Dobbins J, et al. Studying Dynamic Plasma Membrane Binding of TCR-CD3 Chains During Immunological Synapse Formation Using Donor-Quenching FRET and FLIM-FRET[J]. The Immune Synapse: Methods and Protocols, 2017: 259-289.<链接> |
|
[19] |
Foster K, Chaddock J, Penn C, et al. Non-cytotoxic protein conjugates: U.S. Patent 9,474,807[P]. 2016-10-25. |
|
[20] |
Araki N, Iida M, Machida K. Bioassay method for detecting physiologically active substance: U.S. Patent 9,316,588[P]. 2016-4-19. |
|
[21] |
Sazinsky S, Michaelson J S, Sathyanarayanan S, et al. Antibodies to icos: U.S. Patent Application 15/076,867[P]. 2016-3-22 |
|
[22] |
李凯. Studies on Innate Immune Activation by HBV Infection and Its Sensing Mechanism in Hepatocytes[J]. 2016. |
|
[23] |
Ip L R H. Effect of INPP4B loss on DNA repair and treatment strategies in ovarian cancer[D]. UCL (University College London), 2016. |
|
[24] |
Thakkar A. Novel hormonal combination therapy for triple negative breast cancer[D]. University of Miami, 2016. |
|
[25] |
Pakdaman Y. In-vitro characterization of STUB1 mutations in recessively inherited spinocerebellar ataxia-16[D]. The University of Bergen, 2016. |
|
[26] |
Caxaria S. Induced pluripotent stem cells (iPSCs) for research and therapy: induction of hepatic differentiation in iPSCs and evaluation of their quality as a model of in vivo development in the context of coagulation[D]. UCL (University College London), 2016.<链接> |
|
[27] |
Bayne R A, Donnachie D J, Kinnell H L, et al. BMP signalling in human fetal ovary somatic cells is modulated in a gene-specific fashion by GREM1 and GREM2[J]. MHR: Basic science of reproductive medicine, 2016, 22(9): 622-633.<链接> |
|
[28] |
Friedrich D. HIF-1 [alpha] Drives Fungal Immunity in Human Macrophages[D]. Universität zu Lübeck, 2016.<链接> |
|
[29] |
Yasuda M, Kawabata J, Akieda-Asai S, et al. Guanylyl cyclase C and guanylin reduce fat droplet accumulation in cattle mesenteric adipose tissue[J]. The Journal of Veterinary Science, 2016.<链接> |
|
[30] |
Campa M J, Moody M A, Zhang R, et al. Interrogation of individual intratumoral B lymphocytes from lung cancer patients for molecular target discovery[J]. Cancer Immunology, Immunotherapy, 2016, 65(2): 171-180.<链接> |
|
[31] |
Kobayashi T, Yagi Y, Nakamura T. Development of Genome Engineering Tools from Plant-Specific PPR Proteins Using Animal Cultured Cells[J]. Chromosome and Genomic Engineering in Plants: Methods and Protocols, 2016: 147-155.<链接> |
|
[32] |
Shikata H, Kaku M, Kojima S I, et al. The effect of magnetic field during freezing and thawing of rat bone marrow-derived mesenchymal stem cells[J]. Cryobiology, 2016, 73(1): 15-19.<链接> |
|
[33] |
Hirakawa M, Matos T, Liu H, et al. Low-dose IL-2 selectively activates subsets of CD4+ Tregs and NK cells[J]. JCI insight, 2016, 1(18).<链接> |
|
[34] |
Durruthy-Durruthy J, Sebastiano V, Wossidlo M, et al. The primate-specific noncoding RNA HPAT5 regulates pluripotency during human preimplantation development and nuclear reprogramming[J]. Nature genetics, 2016, 48(1): 44-52.<链接> |
|
[35] |
Caxaria S, Arthold S, Nathwani A C, et al. Generation of integration-free patient specific iPS cells using episomal plasmids under feeder free conditions[J]. Patient-Specific Induced Pluripotent Stem Cell Models: Generation and Characterization, 2016: 355-366.<链接> |
|
[36] |
Nonomura Y, Otsuka A, Nakashima C, et al. Peripheral blood Th9 cells are a possible pharmacodynamic biomarker of nivolumab treatment efficacy in metastatic melanoma patients[J]. Oncoimmunology, 2016, 5(12): e1248327.<链接> |
|
[37] |
Burridge P W, Diecke S, Matsa E, et al. Modeling cardiovascular diseases with patient-specific human pluripotent stem cell-derived cardiomyocytes[J]. Patient-Specific Induced Pluripotent Stem Cell Models: Generation and Characterization, 2016: 119-130.<链接> |
|
[38] |
Mendonça M C P, Soares E S, de Jesus M B, et al. PEGylation of Reduced Graphene Oxide Induces Toxicity in Cells of the Blood–Brain Barrier: An in Vitro and in Vivo Study[J]. Molecular pharmaceutics, 2016, 13(11): 3913-3924.<链接> |
|
[39] |
Eldaim A, Hashimoto O, Ohtsuki H, et al. Expression of uncoupling protein 1 in bovine muscle cells[J]. Journal of animal science, 2016, 94(12): 5097-5104.<链接> |
|
[40] |
Zhen A, Rezek V, Youn C, et al. Stem-cell based engineered immunity against HIV infection in the humanized mouse model[J]. JoVE (Journal of Visualized Experiments), 2016 (113): e54048-e54048.<链接> |
|
[41] |
Bastian N A, Bayne R A, Hummitzsch K, et al. Regulation of fibrillins and modulators of TGFβ in fetal bovine and human ovaries[J]. Reproduction, 2016, 152(2): 127-137.<链接> |
|
[42] |
Eto K, Takayama N, Nakamura S, et al. Method for producing differentiated cells: U.S. Patent 9,200,254[P]. 2015-12-1. |
|
[43] |
Eto K, Takayama N, Nakamura S, et al. Novel Method for Producing Differentiated Cells: U.S. Patent Application 14/925,508[P]. 2015-10-28. |
|
[44] |
Yamashita J, Takeda M. Cd82-positive cardiac progenitor cells: U.S. Patent Application 15/308,147[P]. 2015-4-16. |
|
[45] |
Cai Y, Sugimoto C, Arainga M, et al. Preferential Destruction of Interstitial Macrophages over Alveolar Macrophages as a Cause of Pulmonary Disease in Simian Immunodeficiency Virus–Infected Rhesus Macaques[J]. The Journal of Immunology, 2015, 195(10): 4884-4891.<链接> |
|
[46] |
Kojima S I, Kaku M, Kawata T, et al. Cranial suture-like gap and bone regeneration after transplantation of cryopreserved MSCs by use of a programmed freezer with magnetic field in rats[J]. Cryobiology, 2015, 70(3): 262-268.<链接> |
|
[47] |
Egawa E Y, Kitamura N, Nakai R, et al. A DNA hybridization system for labeling of neural stem cells with SPIO nanoparticles for MRI monitoring post-transplantation[J]. Biomaterials, 2015, 54: 158-167.<链接> |
|
[48] |
Durruthy J D, Sebastiano V. Derivation of GMP-Compliant Integration-Free hiPSCs Using Modified mRNAs[J]. Stem Cells and Good Manufacturing Practices: Methods, Protocols, and Regulations, 2015: 31-42.<链接> |
|
[49] |
Sato Y, Sasaki T, Takahashi S, et al. Development of a highly reproducible system to evaluate inhibition of cytochrome P450 3A4 activity by natural medicines[J]. Journal of Pharmacy & Pharmaceutical Sciences, 2015, 18(4): 316-327.<链接> |
|
[50] |
Burridge P W, Holmström A, Wu J C. Chemically defined culture and cardiomyocyte differentiation of human pluripotent stem cells[J]. Current protocols in human genetics, 2015: 21.3. 1-21.3. 15.<链接> |
|
[51] |
Käding N. Hypoxia Regulates Host Cell Metabolism and Thereby Enhancing Clamydia Pneumonia Growth[D]. Zentrale Hochschulbibliothek Lübeck, 2015.<链接> |
|
[52] |
Lu S. Calcium Dependent Regulatory Mechanism in Wolfram Syndrome: A Dissertation[J]. 2015. |
|
[53] |
Garvican E R, Cree S, Bull L, et al. Viability of equine mesenchymal stem cells during transport and implantation[J]. Stem cell research & therapy, 2014, 5(4): 1.<链接> |
|
[54] |
Deng X, Terunuma H, Nieda M. Method for producing nk cell-enriched blood preparation: U.S. Patent Application 14/508,745[P]. 2014-10-7. |
|
[55] |
Foster K, Chaddock J, Penn C, et al. Non-cytotoxic protein conjugates: U.S. Patent 8,778,634[P]. 2014-7-15. |
|
[56] |
Ramathal C Y, Dumuthy-Durruthy J, Pera R A R, et al. Generation of male germ cells: U.S. Patent Application 14/904,396[P]. 2014-7-10 |
|
[57] |
Ince T A. Assays, methods and kits for analyzing sensitivity and resistance to anti-cancer drugs, predicting a cancer patient's prognosis, and personalized treatment strategies: U.S. Patent Application 14/894,595[P]. 2014-6-4. |
|
[58] |
Nishio M, Saeki K. Differentiation of human pluripotent stem cells into highly functional classical brown adipocytes[J]. Methods Enzymol, 2014, 537: 177-197.<链接> |
|
[59] |
Durruthy-Durruthy J, Briggs S F, Awe J, et al. Rapid and efficient conversion of integration-free human induced pluripotent stem cells to GMP-grade culture conditions[J]. PloS one, 2014, 9(4): e94231.<链接> |
|
[60] |
Koido S, Homma S, Okamoto M, et al. Treatment with Chemotherapy and Dendritic Cells Pulsed with Multiple Wilms' Tumor 1 (WT1)–Specific MHC Class I/II–Restricted Epitopes for Pancreatic Cancer[J]. Clinical Cancer Research, 2014, 20(16): 4228-4239.<链接> |
|
[61] |
Patz Jr E F. Antibodies Expressed by Intratumoral B Cells as the Basis for a Diagnostic Test for Lung Cancer[R]. DUKE UNIV DURHAM NC, 2014.<链接> |
|
[62] |
Kaku M, Shimasue H, Ohtani J, et al. A case of tooth autotransplantation after long-term cryopreservation using a programmed freezer with a magnetic field[J]. The Angle Orthodontist, 2014, 85(3): 518-524.<链接> |
|
[63] |
Kaku M, Koseki H, Kojima S, et al. Cranial bone regeneration after cranioplasty using cryopreserved autogenous bone by a programmed freezer with a magnetic field in rats[J]. CryoLetters, 2014, 35(6): 451-461.<链接> |
|
[64] |
Koido S, Kinoshita S, Mogami T, et al. Immunological assessment of cryotherapy in breast cancer patients[J]. Anticancer research, 2014, 34(9): 4869-4876.<链接> |
|
[65] |
Sazuka S, Katsuno T, Nakagawa T, et al. Fibrocytes are involved in inflammation as well as fibrosis in the pathogenesis of Crohn's disease[J]. Digestive diseases and sciences, 2014, 59(4): 760-768.<链接> |
|
[66] |
Lin S L, Lee S Y, Lin Y C, et al. Evaluation of mechanical and histological properties of cryopreserved human premolars under short-term preservation: A preliminary study[J]. Journal of Dental Sciences, 2014, 9(3): 244-248.<链接> |
|
[67] |
Poole E, Reeves M, Sinclair J H. The use of primary human cells (fibroblasts, monocytes, and others) to assess human cytomegalovirus function[J]. Human Cytomegaloviruses: Methods and Protocols, 2014: 81-98.<链接> |
|
[68] |
Garvican E R, Dudhia J, Alves A L, et al. Mesenchymal stem cells modulate release of matrix proteins from tendon surfaces in vitro: a potential beneficial therapeutic effect[J]. Regenerative medicine, 2014, 9(3): 295-308.<链接> |
|
[69] |
Skinner J A, Zurawski S M, Sugimoto C, et al. Immunologic characterization of a rhesus macaque H1N1 challenge model for candidate influenza vaccine assessment[J]. Clinical and Vaccine Immunology, 2014: CVI. 00547-14.<链接> |
|
[70] |
Terunuma H, Deng X, Nieda M. Method for producing nk cell-enriched blood preparation: U.S. Patent Application 14/780,394[P]. 2013-3-27. |
|
[71] |
Cho M, Yamazaki T, Endo M, et al. Anti-Phospholipase D4 Antibody: U.S. Patent Application 14/375,266[P]. 2013-1-31. |
|
[72] |
Bhandari S. Radiological, clinical and laboratory based studies in the pathogenesis of desmoid tumours in familial adenomatous polyposis[J]. 2013. |
|
[73] |
Gonzàlez Juncà A. Study of molecular mechanisms implicated in the TGF-beta oncogenic effect in Glioma[J]. 2013. |
|
[74] |
Koseki H, Kaku M, Kawata T, et al. Cryopreservation of osteoblasts by use of a programmed freezer with a magnetic field[J]. CryoLetters, 2013, 34(1): 10-19.<链接> |
|
[75] |
Naito H, Yoshimura M, Mizuno T, et al. The advantages of three‐dimensional culture in a collagen hydrogel for stem cell differentiation[J]. Journal of Biomedical Materials Research Part A, 2013, 101(10): 2838-2845.<链接> |
|
[76] |
Stec M, Baran J, Szatanek R, et al. Properties of monocytes generated from haematopoietic CD34+ stem cells from bone marrow of colon cancer patients[J]. Cancer Immunology, Immunotherapy, 2013, 62(4): 705-713.<链接> |
|
[77] |
Müller L, Brighton L E, Carson J L, et al. Culturing of human nasal epithelial cells at the air liquid interface[J]. Journal of visualized experiments: JoVE, 2013 (80).<链接> |
|
[78] |
Kalaszczynska I, Ruminski S, Platek A E, et al. Substantial differences between human and ovine mesenchymal stem cells in response to osteogenic media: how to explain and how to manage?[J]. BioResearch open access, 2013, 2(5): 356-363.<链接> |
|
[79] |
Tamai Y, Hasegawa A, Takamori A, et al. Potential Contribution of a Novel Tax Epitope–Specific CD4+ T Cells to Graft-versus-Tax Effect in Adult T Cell Leukemia Patients after Allogeneic Hematopoietic Stem Cell Transplantation[J]. The Journal of Immunology, 2013, 190(8): 4382-4392.<链接> |
|
[80] |
Kasai K, Nakashima H, Liu F, et al. Toxicology and biodistribution studies for MGH2. 1, an oncolytic virus that expresses two prodrug-activating genes, in combination with prodrugs[J]. Molecular Therapy-Nucleic Acids, 2013, 2: e113.<链接> |
|
[81] |
Deng X, Terunuma H, Nieda M. Method for producing nk cell-enriched blood preparation: U.S. Patent Application 13/980,777[P]. 2012-1-17. |
|
[82] |
Somm E, Bonnet N, Martinez A, et al. A botulinum toxin–derived targeted secretion inhibitor downregulates the GH/IGF1 axis[J]. The Journal of clinical investigation, 2012, 122(9): 3295.<链接> |
|
[83] |
Takaoka E, Sonobe H, Akimaru K, et al. Multiple sites of highly amplified DNA sequences detected by molecular cytogenetic analysis in HS-RMS-2, a new pleomorphic rhabdomyosarcoma cell line[J]. American journal of cancer research, 2012, 2(2): 141.<链接> |
|
[84] |
Fahlbusch F B, Dawood Y, Hartner A, et al. Cullin 7 and Fbxw 8 expression in trophoblastic cells is regulated via oxygen tension: implications for intrauterine growth restriction?[J]. The Journal of Maternal-Fetal & Neonatal Medicine, 2012, 25(11): 2209-2215.<链接> |
|
[85] |
Aloé S, Weber F, Behr B, et al. Modulatory effects of bovine seminal plasma on uterine inflammatory processes[J]. Reproduction in domestic animals, 2012, 47(1): 12-19.<链接> |
|
[86] |
Gupta A, Bhakta S. An integrated surrogate model for screening of drugs against Mycobacterium tuberculosis[J]. Journal of antimicrobial chemotherapy, 2012, 67(6): 1380-1391.<链接> |
|
[87] |
Saeki K. Feeder-Free Culture for High Efficiency Production of Subculturable Vascular Endothelial Cells from Human Embryonic Stem Cells[J]. Human Embryonic and Induced Pluripotent Stem Cells: Lineage-Specific Differentiation Protocols, 2012: 277-294.<链接> |
|
[88] |
Yamazaki T, Okabe H, Kobayashi S, et al. Cancer stem cell mass and process for production thereof: U.S. Patent Application 13/878,181[P]. 2011-10-6. |
|
[89] |
Deng X, Terunuma H, Nieda M. Method for producing nk cell-enriched blood product: U.S. Patent Application 13/577,476[P]. 2011-2-4. |
|
[90] |
Sugii S, Kida Y, Berggren W T, et al. Feeder-independent ips cell derivation from human and mouse adipose stem cells[J]. Nature protocols, 2011, 6(3): 346.<链接> |
|
[91] |
Shinada T, Akimoto T, Zhu Y, et al. Modulation of viability of live cells by focused ion‐beam exposure[J]. Biotechnology and bioengineering, 2011, 108(1): 222-225.<链接> |
|
[92] |
Huang M S, Chang W J, Huang H M, et al. Effects of transportation time after extraction on the magnetic cryopreservation of pulp cells of rat dental pulp[J]. Journal of Dental Sciences, 2011, 6(1): 48-52.<链接> |
|
[93] |
Sato D, Suzuki Y, Kano T, et al. Tonsillar TLR9 expression and efficacy of tonsillectomy with steroid pulse therapy in IgA nephropathy patients[J]. Nephrology Dialysis Transplantation, 2011, 27(3): 1090-1097.<链接> |
|
[94] |
Kamada H, Kaku M, Kawata T, et al. In-vitro and in-vivo study of periodontal ligament cryopreserved with a magnetic field[J]. American Journal of Orthodontics and Dentofacial Orthopedics, 2011, 140(6): 799-805.<链接> |
|
[95] |
Bui H T, Wakayama S, Mizutani E, et al. Essential role of paternal chromatin in the regulation of transcriptional activity during mouse preimplantation development[J]. Reproduction, 2011, 141(1): 67-77.<链接> |
|
[96] |
Takata Y, Kishine H, Sone T, et al. Generation of iPS cells using a BacMam multigene expression system[J]. Cell structure and function, 2011, 36(2): 209-222.<链接> |
|
[97] |
Benko Z, Zhao R Y. Zeocin for selection of bleMX6 resistance in fission yeast[J]. Biotechniques, 2011, 51(1): 57-60.<链接> |
|
[98] |
Abedini S, Kaku M, Kawata T, et al. Effects of cryopreservation with a newly-developed magnetic field programmed freezer on periodontal ligament cells and pulp tissues[J]. Cryobiology, 2011, 62(3): 181-187.<链接> |
|
[99] |
Oshima-Sudo N, Li Q, Hoshino Y, et al. Optimized method for culturing outgrowth endothelial progenitor cells[J]. Inflammation and Regeneration, 2011, 31(2): 219-227.<链接> |
|
[100] |
Araki N. Bioassay method for antibody against thyroid-stimulating hormone receptor, measurement kit for the antibody, and novel genetically modified cell for use in the bioassay method or the measurement kit: U.S. Patent Application 13/381,402[P]. 2010-6-24. |
|
[101] |
Foster K, Chaddock J, Marks P, et al. Fusion proteins: U.S. Patent 7,659,092[P]. 2010-2-9. |
|
[102] |
Mieno S, Boodhwani M, Robich M P, et al. Effects of diabetes mellitus on VEGF‐induced proliferation response in bone marrow derived endothelial progenitor cells[J]. Journal of cardiac surgery, 2010, 25(5): 618-625.<链接> |
|
[103] |
Kaku M, Kamada H, Kawata T, et al. Cryopreservation of periodontal ligament cells with magnetic field for tooth banking[J]. Cryobiology, 2010, 61(1): 73-78.<链接> |
|
[104] |
Kawata T, Kaku M, Fujita T, et al. Water molecule movement by a magnetic field in freezing for tooth banking[J]. Biomedical Research, 2010, 21(4).<链接> |
|
[105] |
Lee S Y, Chiang P C, Tsai Y H, et al. Effects of cryopreservation of intact teeth on the isolated dental pulp stem cells[J]. Journal of Endodontics, 2010, 36(8): 1336-1340.<链接> |
|
[106] |
Huang Y H, Yang J C, Wang C W, et al. Dental stem cells and tooth banking for regenerative medicine[J]. Journal of Experimental & Clinical Medicine, 2010, 2(3): 111-117.<链接> |
|
[107] |
Kwon H J, Enomoto T, Shimogawara M, et al. Benchmarks[J]. Biotechniques, 2010, 48: 460-462.<链接> |
|
[108] |
Shimizu Y, Takamori A, Utsunomiya A, et al. Impaired Tax‐specific T‐cell responses with insufficient control of HTLV‐1 in a subgroup of individuals at asymptomatic and smoldering stages[J]. Cancer science, 2009, 100(3): 481-489.<链接> |
|
[109] |
Park H S, Cho S G, Park M J, et al. Bone marrow T cells are superior to splenic T cells to induce chimeric conversion after non-myeloablative bone marrow transplantation[J]. The Korean journal of internal medicine, 2009, 24(3): 252.<链接> |
|
[110] |
Enosawa S, Miyamoto Y, Ikeya T. Frozen cell immobilized product, primary hepatocyte culture tool, and method for producing primary hepatocyte culture tool: U.S. Patent Application 12/738,809[P]. 2008-9-11. |
|
[111] |
DePinho R A, Stommel J M. Receptor tyrosine kinase profiling: U.S. Patent Application 12/450,820[P]. 2008-4-11. |
|
[112] |
Mieno S, Clements R T, Boodhwani M, et al. Characteristics and Function of Cryopreserved Bone Marrow–Derived Endothelial Progenitor Cells[J]. The Annals of thoracic surgery, 2008, 85(4): 1361-1366.<链接> |
|
[113] |
Warren C. The Response of HN4 Cells to Porphyromonas gingivalis DNA[D]. , 2008. |
|
[114] |
Hikichi T, Wakayama S, Mizutani E, et al. Differentiation potential of parthenogenetic embryonic stem cells is improved by nuclear transfer[J]. Stem Cells, 2007, 25(1): 46-53.<链接> |
|
[115] |
Zaidi S K, Pande S, Pratap J, et al. Runx2 deficiency and defective subnuclear targeting bypass senescence to promote immortalization and tumorigenic potential[J]. Proceedings of the National Academy of Sciences, 2007, 104(50): 19861-19866.<链接> |
|
[116] |
Hikichi T, Wakayama S, Mizutani E, et al. Differentiation potential of parthenogenetic embryonic stem cells is improved by nuclear transfer[J]. Stem Cells, 2007, 25(1): 46-53.<链接> |
|
[117] |
Liu D G, Kobayashi T, Onishi A, et al. Relation between human decay‐accelerating factor (hDAF) expression in pig cells and inhibition of human serum anti‐pig cytotoxicity: value of highly expressed hDAF for xenotransplantation[J]. Xenotransplantation, 2007, 14(1): 67-73.<链接> |
|
[118] |
Ishii H, Iinuma A, Osumi K, et al. Canine tumor treatment method, pharmaceutical formulation applied thereto, and method of cryogenically preserving cells used therewith: U.S. Patent Application 11/465,892[P]. 2006-8-21. |
|
[119] |
Hatoya S, Sugiyama Y, Torii R, et al. Effect of co-culturing with embryonic fibroblasts on IVM, IVF and IVC of canine oocytes[J]. Theriogenology, 2006, 66(5): 1083-1090.<链接> |
|
[120] |
Sasaki M, Kato Y, Yamada H, et al. Development of a novel serum‐free freezing medium for mammalian cells using the silk protein sericin[J]. Biotechnology and applied biochemistry, 2005, 42(2): 183-188.<链接> |
|
[121] |
Haynes J E. Pseudonyms of Authors: Including Anonyms and Initialisms[M]. JE Haynes, 1882.<链接> |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |
| 302-14681 | BAMBANKER BAMBANKER冻存液 |
120 mL | – |
| 306-14684 | BAMBANKER BAMBANKER冻存液 |
20 mLx5 | – |
| 306-95921 | BAMBANKER Direct BAMBANKER直接冻存液 |
20 mL | – |
|
品牌:Wako
CAS No.: 储存条件:2-10℃ 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
039-23511 |
for Cell Culture | 100 ml | – | 930.00 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司。
产品描述相关资料下载相关产品浏览记录 Culturesure无血清通用动物细胞冻存液,内毒素含量最大是3.0EU/ml。灭菌实验、支原体实验都已通过测试。
|
品牌:Lymphotec
CAS No.: 储存条件:2-10℃ 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
302-14681 |
– | 120 ml | – | 1,570.00 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司。
产品描述相关资料下载相关产品浏览记录
无血清细胞冻存液。
使用方便,收集的细胞用该试剂1ml重悬后即可放入-80度保存,可在-80度长期保存,也可转移到液氮中保存。
与实验室常用的细胞冻存液相比,省却了逐步降温步骤,极大方便实验者的操作,而且不使用血清,另外细胞的复苏效率比较高。
含有DMSO。
|
品牌:Lymphotec
CAS No.: 储存条件:2-10℃ 纯度:– |
| 产品编号
(生产商编号) |
等级 | 规格 | 运输包装 | 零售价(RMB) | 库存情况 | 参考值 |
|
306-14684 |
– | 20 ml×5 | – | 1,470.00 | – | – |
* 干冰运输、大包装及大批量的产品需酌情添加运输费用
* 零售价、促销产品折扣、运输费用、库存情况、产品及包装规格可能因各种原因有所变动,恕不另行通知,确切详情请联系上海金畔生物科技有限公司。
产品描述相关资料下载相关产品浏览记录
无血清细胞冻存液。
使用方便,收集的细胞用该试剂1ml重悬后即可放入-80度保存,可在-80度长期保存,也可转移到液氮中保存。
与实验室常用的细胞冻存液相比,省却了逐步降温步骤,极大方便实验者的操作,而且不使用血清,另外细胞的复苏效率比较高。
含有DMSO。