Luna® 通用 qPCR 预混液 收藏










Download:
- isoschizomers |
- compatible ends |
- single letter code
相关产品:
特性
概述
快速、灵敏、精确的实时荧光染料定量检测 DNA 和 cDNA
使用实时荧光染料定量 PCR 时,最常用的荧光染料是 SYBR® Green I,后者与双链 DNA 结合,检测每个 PCR 循环中的 DNA 扩增情况。Cq 值是循环数量值,即检测到的荧光信号超过背景本底信号域值所经历的循环数,该 Cq 值可用于评估两个或两个以上的样本之间的相对丰度,也可以与已知浓度系列稀释的标准曲线进行对比,读取样本绝对值。
NEB Luna Universal qPCR Master Mix 是经过优化的 2X 预混液,可以用于实时定量 PCR检测和目标 DNA 的定量,适用于具有 SYBR®/FAM 通道的大部分 qPCR 设备。预混液含有热启动 Taq DNA 聚合酶及独特校正染料,与一系列 qPCR 设备兼容;预混液中使用了 dUTP,以防止产物残留污染;预混液中还加有非荧光染料,便于建立反应时进行肉眼观察,该染料的光谱与 qPCR 荧光染料不重叠,因此不会影响到实时检测数值。
预混液为 2X,包含除了模板和引物以外,用于 PCR 扩增和定量检测的所有组分。可以使用商业化的 qPCR 分析引物,用 Luna qPCR 产品进行基因组 DNA 或者 cDNA 的定量分析。
图表一:NEB 的 Luna Universal qPCR Master Mix 为 qPCR 带来更高灵敏度及可重复性
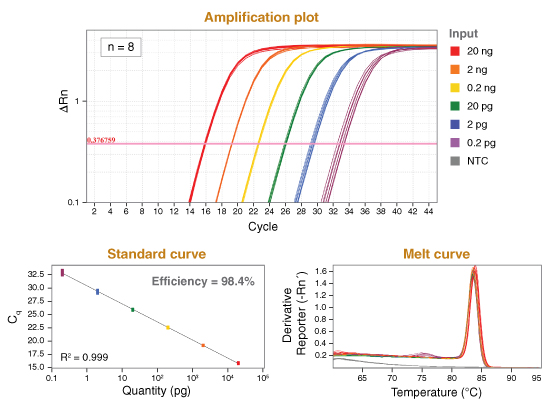
使用 Luna Universal qPCR Master Mix 检测目标中 GAPDH 基因的表达情况,模板为 6个分别 10 倍稀释的 Jurkat cDNA (20 ng – 0.2 pg),每个浓度的样品做8个复孔。cDNA 是使用 NEB Protoscript® II First Strand cDNA Synthesis Kit (NEB #E6560) 从 Jurkat 的总 RNA 反转录得来。
图表二:NEB 的 Luna Universal qPCR Master Mix 为不同来源的 DNA 都能提供更高灵敏度和精确度的检测和定量
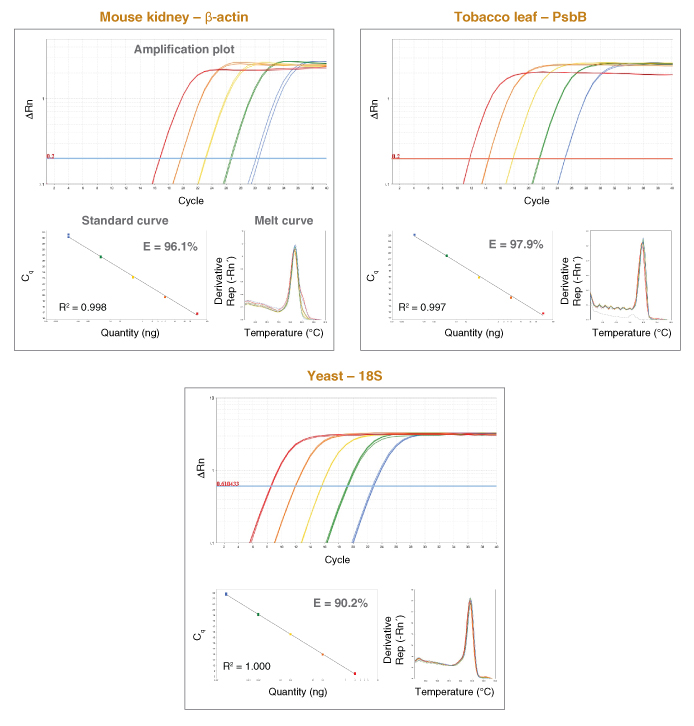
Luna Universal qPCR Master Mix 可以检测不同来源的基因组 DNA。使用 ABI 7500 快速荧光定量仪器,50 ng – 0.5 pg 的基因组 DNA 对目标进行实时定量检测。基因组 DNA使用传统的柱纯化方法纯化。无论从小鼠肾脏的基因组检测 ACTB 基因、烟草基因组 DNA 检测 psbB 基因、还是从酵母基因组 DNA 中检测 rdn18S,Luna 产品都有非常优秀的表现。
图表三:通过与市场上基于染料的 qPCR 试剂对比,NEB 的 Luna 产品体现出了更优的稳定性和特异性
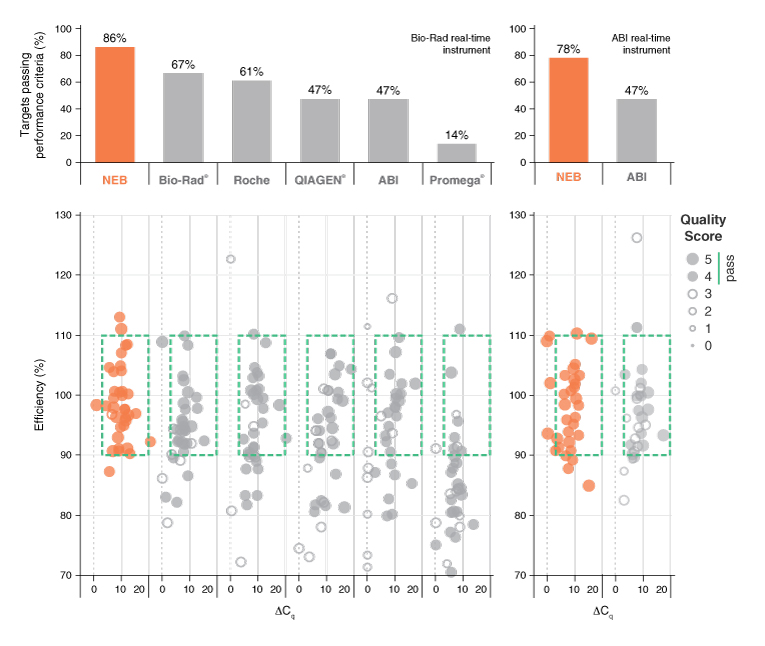
使用 NEB 公司和其它供应商的试剂,分别对来自于 Jurkat 基因组 DNA或 Jurkat cDNA不同丰度、长度和 GC 含量的 16-18 个目的基因进行检测(使用 Bio-Rad 机器检测 10 个基因组模板和 8 cDNA 模板,使用 ABI 的机器检测9个基因组模板和7 个 cDNA 模板)。每份检测结果由两个实验者根据厂商要求分别得到。使用反应效率、最低检测值以及无模板扩增来衡量结果(ΔCq = average Cq of lowest input – average Cq of non-template control)。此外,一致性、可重复性以及曲线的整体质量评估也作为实验的参考(标准分数)。上面的点状图展示了符合可接受的性能标准的百分比(绿框圈起来的点的标准分>3)。不同厂商的结果如上图所示,从左到右分别是:NEB;Bio-Rad, SsoAdvanced™ Universal SYBR® Green Supermix; Roche, FastStart™ SYBR Green Master; QIAGEN, QuantiTect® SYBR Green PCR Kit; ABI, PowerUP™ SYBR Green Master Mix; Promega®, GoTaq® qPCR Master Mix。
注释
1. 引物设计
使用相关软件(如 Primer 3)设计 qPCR 引物时,在减少非特异性扩增和引物二聚体的情况下提高扩增成功率。引物的 GC 含量为 40–60% 可以保证最大的扩增效率。在可能的情况下,尽可能多的输入目标周围区域序列,以便引物序列设计更加完善。使用检索功能,检索相关数据库以避免非特异性扩增。如果模板是 cDNA ,在设计引物的时候可以跨内含子区域来避免基因组的非特异性扩增。相反,如果引物设计在内含子区域则可以保证基因组区域的特异性扩增。
2. 引物浓度
对于大多数模板来说,引物的终浓度 250 nM 就可以达到要求。如果需要的话,引物的浓度可以在 100–500 nM 之间优化。
3. 扩增子长度
为了确保 qPCR 结果的成功和一致性,PCR 效率的最大化非常重要。其中一方面就是设计短的 PCR 产物(70-200 bp)。如果反应产物超出范围,可能需要对实验进行优化(比如增加延伸时间等)
4. 模板准备及相关浓度
Luna qPCR 试剂与通过典型的核酸纯化方法纯化的 DNA 样本都兼容。制备好的 DNA 可以长期稳定储存在包含 EDTA 的缓冲液中(如 1X TE),实验时使用 TE buffer 或者水进行稀释。
一般来说,标准品和未知样品的浓度范围应该在 1 个拷贝到 106 个拷贝之间。如果是大型基因组样本(如人类或老鼠的 gDNA)一般浓度为 50 ng-1 pg。如果是小型基因组样本,可以参考使用1 个拷贝到 106 个拷贝的浓度。对于单一样本的稀释,样本中需要包含多个拷贝和空白对照。对于 cDNA 样本,可以使用 1 μg–0.1 pg 的 RNA 的反转录产物。cDNA 样本不需要纯化,但是在使用之前需要至少稀释 10 倍
5. ROX 校正染料
有些实时定量设备建议使用校正染料(通常是 ROX)来校正由于气泡、微小的体积差别、管与管之间的差异及反应过程中尘埃或者微粒的自发荧光造成的反应差距。Luna Universal qPCR Master Mix 包含了通用型的校正染料,可以兼容不需要使用校正染料以及需要使用低浓度或者高浓度校正染料(ROX)的一系列的荧光定量检测仪器。因此,在使用这些仪器进行 qPCR 实验时,不需要额外的组分。
6. 预防污染
qPCR 是一种非常灵敏的检测方法,前个 qPCR 产物污染下一个样本会带来一系列的问题,如假阳性及灵敏度的下降。防止污染的最好办法就是严格按照程序操作,避免扩增后的开盖。为了进一步满足预防交叉污染的要求,Luna Universal qPCR Master Mix 中包含了 dUTP/dTTP,从而可以在扩增过程中将 U 掺入到 DNA 产物中。qPCR 前使用尿嘧啶 DNA 糖基化酶(UDG)进行预先处理,就可以水解含有尿嘧啶的产物,以防止污染后续试验。使用能够完全失活的 UDG 是至关重要的,否则 UDG 会破坏新合成的 qPCR 产物。
为了避免产物携带污染,在反应体系中加入 0.2 units/μl 的南极热敏 UDG(NEB #M0372)。欲将污染的可能性降到最低,最好在室温下建立反应或者在变性步骤前加上
25℃ 温育 10 分钟
7. 反应条件设定
由于聚合酶的热启动性,在实验前不需要预热机器,也不需要在冰上加样。
如果使用96 孔板,建议使用 20 μl 反应体积。
如果使用 384 孔板,建议使用 10 μl 反应体积。在设定仪器的循环条件时,保证在延伸结束时包含一次读板并在循环结束后生成溶解曲线以分析产物的特异性。
大部分应用分析反应 40 个循环就可以,低起始量的样本可以反应 45 个循环。
